Việc sử dụng xét nghiệm miễn dịch liên kết với enzyme (ELISA) để phát hiện protein (kháng nguyên hoặc kháng thể) là một trong những công cụ chẩn đoán sẵn có nhất trên toàn thế giới và ngày nay được sử dụng nhiều trong thú y ngành chăn nuôi heo. Xét nghiệm này thường được sử dụng trong giám sát và theo dõi dịch bệnh cũng như là một công cụ chẩn đoán. Vì các bác sĩ thú y ngành heo thường xuyên sử dụng công cụ này nên điều quan trọng là phải hiểu cơ chế hoạt động của xét nghiệm, những gì nó phát hiện được cũng như những ưu điểm và nhược điểm của nó khi diễn giải kết quả. Điều quan trọng cần nhớ là mặc dù người ta đang sử dụng cùng một công nghệ cho các mầm bệnh khác nhau, nhưng sẽ có sự khác biệt trong cách diễn giải những kết quả này.
Thông tin xét nghiệm
Các xét nghiệm ELISA được thiết kế để phát hiện các kháng nguyên (antigen) hoặc kháng thể (antibody) chống lại vi khuẩn hoặc virus. Kháng nguyên là các protein ngoại lai kích thích sản xuất kháng thể (antigen = antibody generator). Khi nói về kháng thể, hãy luôn nghĩ rằng chúng chống lại protein. Khi thiết kế xét nghiệm, nhà sản xuất hoặc phòng thí nghiệm quyết định loại protein hoặc nhóm protein cụ thể mà họ muốn nhắm mục tiêu. Nếu ELISA nhắm mục tiêu protein nằm trực tiếp trên vi khuẩn hoặc virus, thì chúng được gọi là ELISA kháng nguyên, trong khi nếu mục tiêu là kháng thể phản ứng với sự xuất hiện của vi khuẩn hoặc virus thì nó được gọi là ELISA kháng thể. Mặc dù có những xét nghiệm ELISA được thiết kế để chỉ nhắm mục tiêu một hoặc hai protein (kháng thể hoặc kháng nguyên), nhưng thực tế có nhiều xét nghiệm nhắm mục tiêu một lượng lớn protein. Các xét nghiệm cũng có thể được thiết kế để phát hiện một loại phản ứng kháng thể cụ thể (IgG, IgM hoặc IgA) hoặc kết hợp các loại này. Mỗi loại kháng thể này có các chức năng cụ thể không thuộc phạm vi của bài viết này.

Khái niệm và quy trình phát hiện kháng thể hoặc kháng nguyên bằng ELISA hoàn toàn giống nhau. Bắt đầu từ việc thu protein đích (kháng nguyên hoặc kháng thể). Đối với các protein đơn lẻ, cần có một quy trình riêng biệt để thu được nồng độ tinh khiết của protein đơn lẻ này. Xác định protein hoặc nhóm protein nào cần nhắm mục tiêu là một quá trình khoa học và phức tạp. Lý tưởng nhất, là xét nghiệm nhắm vào một loại protein duy nhất đặc trưng đối với mầm bệnh đang quan tâm (không phản ứng chéo với các mầm bệnh khác), có tính sinh miễn dịch cao (để phát hiện kháng thể) hoặc được tìm thấy ở nồng độ cao (để phát hiện kháng nguyên); nó nhắm đến một loại protein được biết là có mối tương quan cao với khả năng bảo hộ chống lại mầm bệnh và luôn luôn hiện diện. Thật không may, nhiều tiêu chí trong số này không được biết đến và loại protein đơn lẻ này (vốn có thể dễ dàng tạo ra và tìm thấy trong mẫu), hoặc hỗn hợp nhiều loại protein (tức là toàn bộ virus hoặc vi khuẩn) thường được sử dụng để thay thế. Mặc dù có thể dễ dàng sử dụng toàn bộ virus hoặc vi khuẩn làm protein đích, nhưng vẫn có nhiều khả năng xảy ra phản ứng chéo với các mầm bệnh khác.
Các bước chung cho quy trình (Xem Hình 1).
- Bước 1. Tráng trước đĩa vi giếng bằng (các) kháng nguyên đích (để phát hiện kháng thể) hoặc kháng thể đích (để phát hiện kháng nguyên).
- Bước 2. Thêm mẫu cần xét nghiệm vào và ủ để kháng nguyên và kháng thể gắn vào nhau.
- Bước 3. Lấy mẫu ra và thêm kháng thể đặc biệt gắn vào mặt đối diện của kháng thể (phần dưới cùng của phần chữ “Y” kháng thể để phát hiện kháng thể) hoặc kháng nguyên (phần trên cùng của chữ “Y” để phát hiện kháng nguyên). Sau đó, mẫu được ủ để cho quá trình gắn kết diễn ra và được rửa sạch để đảm bảo loại bỏ mọi kháng thể hoặc kháng nguyên không gắn kết (nghĩa là không phải mục tiêu).
- Bước 4. Thêm kháng thể được đánh dấu bằng đầu dò (detector) có thể phát huỳnh quang và sẽ gắn vào các kháng thể đặc biệt được thêm vào ở Bước 3 (gắn vào phần dưới cùng của chữ “Y” của kháng thể; cùng một mục tiêu dù phát hiện kháng nguyên hay kháng thể). Sau đó, mẫu được ủ một lần nữa để cho quá trình gắn kết diễn ra và được rửa sạch để đảm bảo loại bỏ mọi kháng thể không được đánh dấu.
- Bước 5. Thêm hoá chất (reagent) có chức năng kích hoạt huỳnh quang của các kháng thể được dán nhãn còn lưu lại và sau đó ủ để diễn ra quá trình gắn kết.
- Bước 6. Mẫu thường được đọc bởi một loại máy đặc biệt ở một bước sóng cụ thể để định lượng sự thay đổi màu sắc (gọi tắt là độ hấp thụ). Có một số biến thể nhỏ đối với quy trình này tuỳ vào loại xét nghiệm là ELISA đang dùng là trực tiếp, gián tiếp hay sandwich, và mỗi xét nghiệm này có những ưu điểm và nhược điểm khác nhau (không được thảo luận ở đây) nhưng cuối cùng thì tất cả chúng đều cho kết quả giống nhau; độ hấp thụ hoặc thay đổi màu sắc càng cao thì nồng độ dự kiến của kháng nguyên hoặc kháng thể đích càng cao trong mẫu xét nghiệm.

Hình 1. Tổng quan về xét nghiệm chẩn đoán dựa trên xét nghiệm miễn dịch hấp thụ liên kết với enzyme (ELISA). ELISA có thể được thực hiện ở các định dạng khác nhau dựa trên sự khác biệt trong việc cố định kháng nguyên và đánh dấu kháng thể. Trong ELISA trực tiếp, (các) kháng nguyên virus liên kết với pha rắn được phát hiện bằng cách bổ sung kháng thể liên hợp. Trong ELISA sandwich, kháng thể bắt giữ được gắn vào pha rắn. (Các) kháng nguyên trong mẫu sẽ liên kết với kháng thể bắt và sau đó được phát hiện bằng kháng thể có đánh dấu enzyme thứ hai. Trong ELISA cạnh tranh, kháng nguyên virus mẫu được ủ trước với kháng thể gốc, sau đó mẫu được thêm vào giếng được tráng bằng kháng thể thứ cấp cùng với kháng nguyên gắn với enzyme, chúng cạnh tranh với kháng nguyên của mẫu để gắn với kháng thể sơ cấp. Càng nhiều kháng nguyên virus trong mẫu, thì càng ít kháng nguyên cộng hợp được gắn và tín hiệu sẽ càng thấp. Nguồn: Phỏng theo Ghaffari et al. 2020.
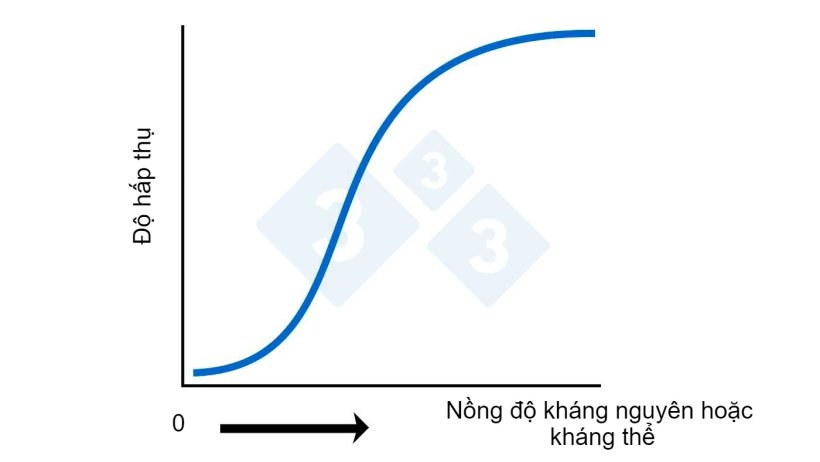
Hình 2A. ELISA – Tính toán nồng độ kháng nguyên hoặc kháng thể dựa trên sự hấp thụ

Hình 2B. ELISA cạnh tranh. Tính toán nồng độ kháng nguyên hoặc kháng thể dựa trên sự hấp thụ.
Ngưỡng xét nghiệm cho mỗi xét nghiệm ELISA có thể khác nhau và được nhà sản xuất thiết lập trước dựa trên độ nhạy và độ đặc hiệu mong muốn của họ. Đối với ELISA trực tiếp, gián tiếp hoặc sandwich, bất kỳ số nào cao hơn ngưỡng được coi là dương tính. Đối với ELISA cạnh tranh, bất kỳ số nào cao hơn ngưỡng được coi là âm tính. Đối với một số xét nghiệm, nhà sản xuất cũng thiết lập vùng màu xám để phân loại các mẫu là “nghi ngờ” vì xét nghiệm có xu hướng có một số phản ứng “ngầm” (phản ứng chéo) khiến khó có điểm giới hạn rõ ràng.
Các kết quả thường, nhưng không phải lúc nào cũng vậy, được báo cáo dưới dạng S:P đã hiệu chỉnh (hoặc sample to positive, tỷ lệ mẫu trên số dương tính) được hiệu chỉnh theo sự thay đổi màu nền được tìm thấy trong các giếng đối chứng âm. Nồng độ kháng thể thường được gọi là “hiệu giá”. Mặc dù không đúng về mặt kỹ thuật, nhưng có thể biện minh từ góc nhìn toàn cảnh. Điểm mấu chốt là khi nói về hiệu giá, là có một mối quan hệ toán học trực tiếp giữa các giá trị (tức là giá trị 20 có số lượng kháng thể gấp đôi so với mẫu có giá trị 10). Với các giá trị ELISA, mối quan hệ toán học trực tiếp này không tồn tại (Xem hình 2A). Một mẫu có giá trị ELISA 2.0 thực sự có nhiều kháng thể hơn đáng kể chứ không chỉ gấp đôi số lượng kháng thể so với giá trị 1.0.
Gộp mẫu để xét nghiệm
Bởi vì các xét nghiệm ELISA phụ thuộc vào nồng độ (tương quan trực tiếp với nồng độ của protein đích [kháng thể hoặc kháng nguyên]) nên việc gộp mẫu để xét nghiệm không được khuyến khích. Việc gộp chung có thể làm tăng đáng kể khả năng bỏ sót mẫu dương tính..
Một số ứng dụng cho xét nghiệm ELISA:
- Phát hiện sự hiện diện của các kháng thể chống lại mầm bệnh mục tiêu – ELISA kháng thể – Cách sử dụng phổ biến nhất
- Xác định phơi nhiễm với mầm bệnh
- Xác định tình trạng miễn dịch thông qua vaccine của động vật
- Xác định thời điểm nhiễm bệnh (thay đổi nồng độ kháng thể) theo thời gian.
- Phát hiện sự hiện diện của mầm bệnh mục tiêu thông qua phát hiện protein/kháng nguyên của mầm bệnh mục tiêu – ELISA kháng nguyên




