Suvaxyn Circo+MH RTU


LA NUEVA VACUNA COMBINADA
ÓPTIMA SEGURIDAD Y EFICACIA
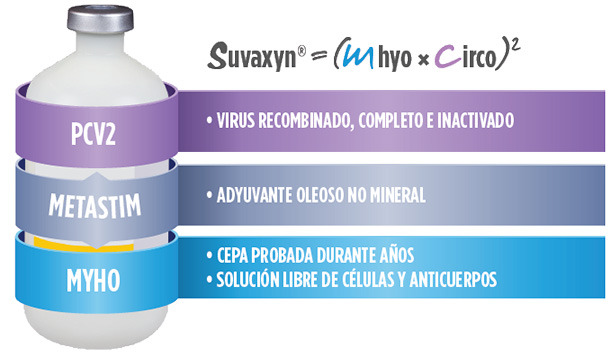
| VIRUS DE PCV COMPLETO, RECOMBINADO E INACTIVADO |
| Virus de PCV completo (recombinando PCV1 y PCV2) |
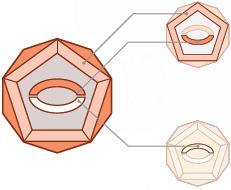 |
PCV2 • Partículas víricas con la apariencia externa de PCV2 (proteínas inmunógenas de la cápside de PCV2) • El gen ORF2 de PCV2 codifica para las proteínas de la cápside |
| PCV1 • El gen ORF1 de PCV1 codifica para la replicación viral |
| METASTIM®: ADYUVANTE ÓPTIMO5,6,7 |
 • Induce una potente respuesta inmune frente a PCV y Mhyo
• Induce una potente respuesta inmune frente a PCV y Mhyo
• Estimula la respuesta serológica y la mediada por células
• Sin aceite mineral
• Excelente perfil de seguridad
• No actividad viricida
• No viscoso para una buena jeringabilidad
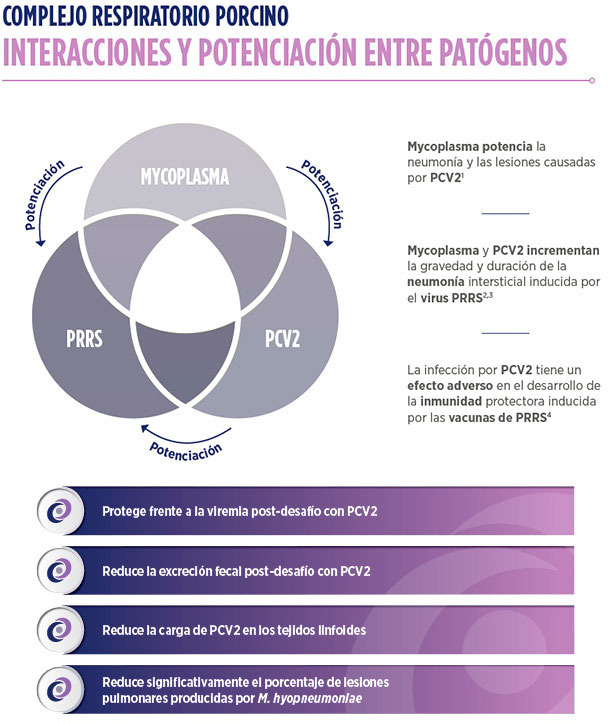
Ofreciendo la eficacia y seguridad ya reconocidas en Suvaxyn® MH One8
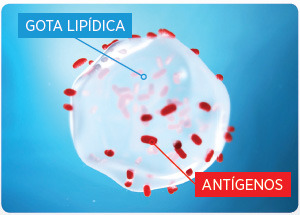
Efecto Caballo de Troya para proteger los antígenos de los anticuerpos
CIENCIA E INNOVACIÓN
SUVAXYN CIRCO+MH RTU TIENE PROCESO DE PRODUCCIÓN ÚNICA PARA LA FRACCIÓN MHYO
PROCESO DE PRODUCCIÓN CONVENCIONAL
Los anticuerpos anti-PCV2 presentes en los medios de cultivo convencionales pueden unirse a los antígenos PCV2, afectando al contenido activo de PCV2
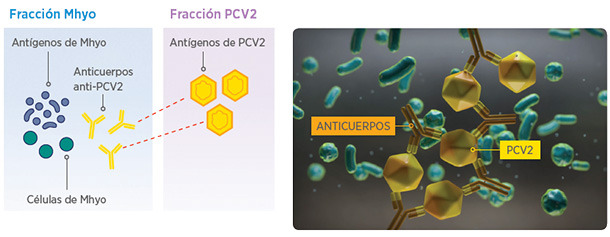

INNOVADOR PROCESO DE PURIFICACIÓN DE MHYO
| 1. FERMENTACIÓN | 2. INACTIVACIÓN | 3. FILTRACIÓN | 4. CROMATOGRAFÍA DE PROTEÍNA A |
 |
 |
 |
 |
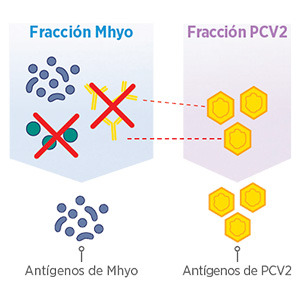
| ELIMINACIÓN DE LAS CÉLULAS DE MHYO |
ELIMINACIÓN DE ANTICUERPOS ANTI-PCV2 |
Solución libre de células de Mycoplasma
• Biomasa total reducida
• Respuesta inmune dirigida
• Seguridad
Formulación libre de anticuerpos
• Compatibilidad antigénica con PCV2
• Eliminación de proteínas extrañas que pueden afectar a la eficacia y seguridad
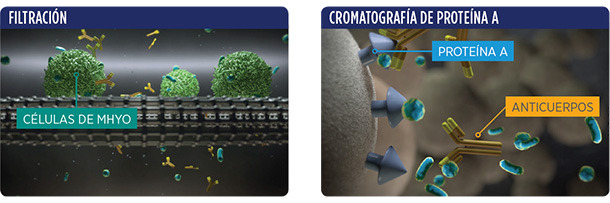
| Filtración del cultivo de Mycoplasma para: • Producir una solución libre de células de Mhyo • Tan protectora frente a M. hyopneumoniae como si usáramos el cultivo completo • Eliminando elementos innecesarios |
Cromatografía de proteína A para: • Unirse selectivamente a las IgG y eliminarlas • Liberar de anticuerpos anti-PCV2 a la fracción de Mhyo |
APLICACIÓN SIMPLE
PROTECCIÓN COMPLETA

Referencias: 1. Halbur PG, Rapp-Gabrielson V, Hoover T, et al. Evaluation of Mycoplasma hyopneumoniae vaccination in a M.hyopneumoniae/PCV2 co-infection model. Presentado en 19th IPVS Congress; Copenhagen, Denmark. 2. Thacker EL, Halbur PG, Ross RF, et al. Mycoplasma hyopneumoniae potentiation of porcine reproductive and respiratory syndrome virus-induced pneumonia. J Clin Microbiol. 1999;37(3):620-7. 3. Harms PA, Sorden SD, Halbur PG, et al. Experimental reproduction of severe disease in CD/CD pigs concurrently infected with type 2 porcine circovirus and porcine reproductive and respiratory syndrome virus. Vet Pathol. 2001;38(5):528-39. 4. Opriessnig T, McKeown NE, Harmon KL, et al. Porcine circovirus type 2 infection decreases the efficacy of a modified live porcine reproductive and respiratory syndrome virus vaccine. Clin Vaccine Immunol. 2006;13(8):923-9. 5. Zoetis Inc. Data on file, study Report No. 32984. 6. Zoetis Inc. Data on file, Study Report No. 32985. 7. Zoetis Inc. Data on file, Study Report No. 32986. 8. Resumen de las características del producto Suvaxyn MH-ONE. 2014.
SUVAXYN CIRCO+MH RTU. Composición: Cada dosis de 2 ml contiene Circovirus porcino recombinante quimérico inactivado tipo 1 expresando la proteína ORF2 del circovirus porcino tipo 2, 2,3-6,4 PR*; Mycoplasma hyopneumoniae inactivado, cepa P-5722-3, 1,5-3,8 PR*. *Unidades de potencia relativa determinadas mediante cuantificación antigénica por ELISA (prueba de potencia in vitro) comparado con una vacuna de referencia. Indicaciones: Para la inmunización activa de cerdos a partir de las 3 semanas de edad frente al Circovirus Porcino tipo 2 (PCV2), para reducir la carga viral en sangre y tejidos linfoides y la excreción viral asociadas con la infección por PCV2. Para la inmunización activa de cerdos a partir de las 3 semanas de edad frente a Mycoplasma hyopneumoniae para reducir las lesiones pulmonares causadas por la infección con Mycoplasma hyopneumoniae. Inicio de la inmunidad: a partir de las 3 semanas tras la vacunación. Duración de la inmunidad: 23 semanas tras la vacunación (PCV2); 16 semanas tras la vacunación (Mycoplasma hyopneumoniae) Contraindicaciones: Ninguna. Advertencias especiales para cada especie de destino: No hay información disponible acerca de la seguridad de esta vacuna en verracos. No utilizar en verracos. Precauciones especiales para su uso en animales: Vacunar solamente animales sanos. Precauciones especiales que deberá adoptar la persona que administre el medicamento a los animales: No procede. Conservación: Conservar y transportar refrigerado (entre 2 ºC y 8 ºC). No congelar. Proteger de la luz. Durante el almacenamiento, podría aparecer un pequeño depósito de color negro y la emulsión podría separarse en dos fases distintas. Tras agitación, el depósito negro desaparece y la emulsión vuelve a ser homogénea. Eliminación: Todo medicamento veterinario no utilizado o los residuos derivados del mismo deberán eliminarse de conformidad con las normativas locales. Tiempo(s) de espera: Cero días.Titular: Zoetis Belgium, S.L. Nº Registro: EU/2/15/190/001-006. Medicamento sujeto a prescripción veterinaria.






