Tác động của sự nhiễm khuẩn đến chất lượng tinh dịch
Tinh dịch của lợn rất nhạy cảm với sự phát triển của vi khuẩn. Sự nhiễm khuẩn có thể xảy ra ở tất cả các giai đoạn của quá trình sản xuất, từ thu thập đến đóng gói. Bài viết này sẽ tìm hiểu về các nguồn và hậu quả của sự nhiễm khuẩn cũng như thảo luận về các giải pháp khả thi cho vấn đề này.
Trong những thập kỷ gần đây, sản xuất tinh dịch tại các trung tâm thụ tinh nhân tạo (AIC) đã tăng đáng kể. Một số địa điểm có thể sản xuất tới 3.000 liều mỗi ngày hoặc nhiều hơn. Đồng thời, các yêu cầu về chất lượng tinh dịch ngày càng cao, nhằm đảm bảo các liều tinh dịch có tính bảo mật sinh học cao, giá trị di truyền và khả năng sinh sản tốt. Ngoài ra, các liều này phải duy trì những chất lượng này trong nhiều ngày trong quá trình bảo quản hoặc vận chuyển đường dài. Do đó, các giai đoạn thu thập tinh dịch và xử lý tinh trùng luôn được các chuyên gia quan tâm đặc biệt. Bài viết này sẽ xem xét các yếu tố ảnh hưởng đến sự nhiễm khuẩn.
Nguồn gốc của sự nhiễm khuẩn
Sự nhiễm khuẩn có thể xảy ra ở tất cả các giai đoạn sản xuất, từ thu thập tinh dịch đến đóng gói cho các liều tinh trùng. Tinh dịch tươi thường chứa vi khuẩn enterobacteria. Các nguồn nhiễm khuẩn trong quá trình thu thập được liệt kê trong Bảng 1. Vi khuẩn có thể xâm nhập vào tinh dịch từ động vật, môi trường và nhân viên. Ngoài ra, kỹ thuật thu thập và chất lượng của nó sẽ ảnh hưởng ban đầu đến số lượng vi khuẩn trong tinh dịch.
Nguồn gốc của sự hiện diện của các chất gây nhiễm trong tinh dịch lợn đực đã được mô tả trong bài báo của Althouse et Lu (Althouse và Lu, 2005): nguồn chính đến từ chính lợn đực. Nguồn ô nhiễm không đến từ con vật được mô tả như Chất độn chuồng và thức ăn, chất có khả năng bay bắn và dính vào lông và da của lợn đực, là một nguồn ô nhiễm không phải từ động vật đã được mô tả. Tinh dịch lợn đực thường và chủ yếu bị ô nhiễm bởi vi khuẩn Gram âm, đặc biệt là họ Enterobacteriaceae, với khoảng 104-105 CFU/ml. Vi khuẩn phân lập chính là Escherichia coli (Althouse và Lu, 2005; Bresciani và cộng sự, 2014). Trong một nghiên cứu khác, sau khi bơm 102 CFU/ml vào tinh dịch lợn đực, không có sự khác biệt về khả năng vận động tổng thể so với nhóm đối chứng (Sepúlveda và cộng sự, 2013). Theo Maroto Martin và cộng sự. (Maroto Martín và cộng sự, 2010), tác động của sự hiện diện của vi khuẩn trong tinh dịch lợn đực đối với kích thước lứa đẻ chỉ xuất hiện từ mức độ ô nhiễm hơn 3,5 x 103 CFU/ml. Hơn nữa, nó không chỉ phụ thuộc vào nồng độ mà còn phụ thuộc vào loại vi khuẩn (Kuster và Althouse, 2016).
Chúng ta phải nhớ rằng vi khuẩn đang sinh sôi nảy nở theo cấp số nhân và tăng gấp đôi tốc độ tăng trưởng 2 sau mỗi 30 phút.
Bảng 1: Các nguồn nhiễm khuẩn trong quá trình khai thác tinh
| Lợn đực | Môi trường | Nhân viên |
| Dương vật | Sàn chuồng | Quần áo |
| Bao quy đầu và dịch bao quy đầu | Không khí | Giày |
| Phần dịch tiết trước xuất tinh | Cốc đựng tinh | Tóc, da, móng tay |
| Lông da | Giá nhảy | Dịch tiết đường hô hấp |
| Dịch tiết đường hô hấp | Côn trùng | |
| Phân |
Sự nhiễm khuẩn tiếp theo có thể xảy ra trong quá trình phân tích tinh dịch, pha loãng và đóng gói. Các nguồn nhiễm khuẩn được trình bày trong Bảng 2. Vi khuẩn có thể được đưa vào tinh dịch thông qua tiếp xúc trực tiếp với các vật liệu và dụng cụ trong phòng thí nghiệm và từ không khí.
Bảng 2: Các nguồn nhiễm khuẩn tại phòng thí nghiệm
| Vật liệu | Môi trường | Nhân viên |
| Nước | Không khí | Quần áo |
| Cốc và hộp đựng thủy tinh | Côn trùng | Giày |
| Ống pipet và đầu típ | Sàn | Tóc, da, móng tay |
| Ống dẫn và kim tiêm | Tường | Dịch tiết đường hô hấp |
| Hộp hoặc bình chứa môi trường | Bàn và kệ để đồ | |
| Thuốc nhuộm tinh | Bồn rửa và cống thoát nước | |
| Ống và chai đựng tinh | Dụng cụ |
Hậu quả của việc nhiễm khuẩn
Một nghiên cứu về việc nhiễm vi khuẩn của xuất tinh tự nhiên cho thấy hầu hết các vi khuẩn không phải là mầm bệnh chính của động vật, nghĩa là hầu hết chúng thường không ảnh hưởng đến sức khỏe lâm sàng của lợn đực giống và khả năng sinh sản của lợn nái.
Sự nhiễm khuẩn có thể ảnh hưởng đến khả năng sinh sản thông qua các cơ chế sau:
- Cạnh tranh dinh dưỡng: Giữa tinh trùng và vi khuẩn trong liều tinh trùng.
- Gây hại cho sự toàn vẹn của tinh trùng: Gây tổn thương acrosome và màng tế bào.
- Gây dính tinh trùng: Làm cho tinh trùng dính đầu vào đầu hoặc thân vào đầu.
- Phát triển tính kháng kháng sinh: Vi khuẩn có thể kháng lại các kháng sinh sử dụng trong môi trường.
- Nhiễm trùng sinh dục ở lợn nái: Dẫn đến mất khả năng sinh sản và các bệnh toàn thân.
Các dấu hiệu chính của sự gia tăng nhiễm vi khuẩn của các liều tinh là:
- Sự kết tụ của tinh dịch.
- Giảm khả năng sống (giảm thời hạn sử dụng của liều).
- Tăng khiếm khuyết hình thái (tổn thương acrosome và màng).
- Tỷ lệ sinh và tổng số heo con được sinh ra tại trang trại chăn nuôi thấp hơn.
Có bằng chứng cho thấy trong hầu hết các trường hợp, liều tinh có tỷ lệ sống thấp và kết tụ cao, các vi khuẩn sau đây đã được phân lập: Alcaligenes xylosoxidans, Burkholderia cepaia, Enterobacter, E. Coli, Serratia, Stenotrophomonas (Bacteriospermia trong tinh dịch lợn để kéo dài, Althouse G 2005.). Mức độ tăng trưởng vi sinh và hậu quả đối với tinh trùng là không thể đoán trước, vì chúng bị ảnh hưởng bởi loại vi khuẩn, số lượng, tính nhạy cảm với kháng sinh, thời gian bảo quản và nhiệt độ bảo quản, pH và sự hiện diện của một hệ vi sinh vật khác. Môi trường tinh dịch cung cấp một môi trường tốt cho vi khuẩn phát triển, đặc biệt là ở nhiệt độ trên 17°C.
Biện pháp vệ sinh để tránh nhiễm khuẩn
Các biện pháp vệ sinh để tránh nhiễm khuẩn nên dựa trên:
- Kiến thức về các nguồn nhiễm khuẩn.
- Thiết kế khu vực thu thập và phòng thí nghiệm tốt.
- Đào tạo nhân viên về vệ sinh cá nhân và vệ sinh chung.
- Giám sát thường xuyên nhiễm khuẩn và xác định các điểm kiểm soát quan trọng.
- Sử dụng các công nghệ mới để kiểm soát nhiễm khuẩn.
Trong quá trình khai thác tinh, lợn đực phải sạch và khô, và lông ở khu vực bao quy đầu phải được cắt. Trong quá trình khai thác, sử dụng hộp đựng sạch dùng một lần hoặc hộp tiệt trùng, túi, găng tay và bộ lọc tinh dịch dùng một lần. Thực hiện theo các quy tắc cơ bản để thu tinh dịch:
- Nơi thu gom phải sạch sẽ và khô ráo (đặc biệt chú ý đến bề mặt bên trong của hình nộm).
- Trước khi khai thác, làm sạch vùng bao quy đầu bằng khăn giấy khô.
- Sau khi lợn đực nhảy, lau sạch dịch ở bao quy đầu.
- Thực hiện theo quy tắc găng tay đôi.
- sau khi cương cứng, giữ chặt dương vật để đầu dương vật được tự do, tránh tinh dịch tiếp xúc với găng tay của người điều khiển.
- Giữ dương vật ở góc 45 ° và di chuyển nó ra khỏi bụng lợn để ngăn bụi bẩn và chất lỏng xâm nhập vào cơ thể con vật.
- Loại bỏ phần gel đầu tiên của xuất tinh. Nó chứa một số lượng lớn vi khuẩn.
- Sau khi thu tinh, cẩn thận loại bỏ bộ lọc với phần gel mà không bóp nó.
- Đóng túi, làm sạch túi bằng khăn khử khuẩn và nhanh chóng đưa đến phòng thí nghiệm.
Từ quan điểm vệ sinh, việc sử dụng bộ thu tinh dịch tự động Collectis là có lợi, vì tinh dịch không tiếp xúc với môi trường bên ngoài, và do đó chúng ta có được:
- Giảm kết tụ, nhiễm khuẩn.
- Cải thiện chất lượng và thời hạn sử dụng của xuất tinh.
- Giảm lỗi do con người và tăng hiệu quả của heo đực.

Ảnh 1. Khu vực khai thác tinh (Otrada GTC).
Vì việc phải loại bỏ tinh do chất lượng kém, kết tụ hoặc tỷ lệ sống sót thấp giảm đi, vào cuối năm chúng ta nhận được nhiều liều tinh chất lượng hơn, do đó làm tăng hiệu quả của lợn đực.
Sau khi chuyển tinh dịch đến phòng thí nghiệm, nguồn nhiễm có thể là bất kỳ vật liệu nào tiếp xúc với tinh dịch:
- Bàn và kệ phải càng trống càng tốt.
- Tất cả các vật liệu tiếp xúc với tinh dịch phải dùng một lần nếu có thể.
- Không bảo quản môi trường đã chuẩn bị ở nhiệt độ phòng quá 6 giờ vì đây là môi trường tốt cho vi khuẩn phát triển (luôn tham khảo IFU).
- Không sử dụng bồn rửa nơi bạn rửa vật tư tiêu hao để vứt bỏ chất thải, tinh dịch hoặc liều cũ. Thông qua việc tiếp xúc hàng ngày với chậu rửa, nhân viên sẽ phát tán vi khuẩn khắp phòng thí nghiệm.
- Máy chiết rót hiện đại đảm bảo vệ sinh khi phân chia liều tinh dịch. Tuy nhiên, việc sử dụng ống và vòi nhiều lần, vệ sinh, rửa, khử trùng và chỉ đơn giản là sử dụng chúng trong thời gian dài sẽ ảnh hưởng đến các đặc tính của bề mặt, có thể thu hút vi khuẩn, cuối cùng chúng sẽ phát triển thành màng sinh học như một nguồn gây ô nhiễm.
Thuốc kháng sinh trong môi trường kiểm soát sự phát triển của vi khuẩn, nhưng chúng không thể bù đắp hoàn toàn cho sự thiếu vệ sinh trong quá trình thu tinh hoặc xử lý tinh dịch.
Ngoài các thiết bị đặc biệt để kiểm soát nhiễm vi khuẩn, ngày càng có nhiều trung tâm khai thác tinh (AIC) giới thiệu các công nghệ mới để đóng gói. Một trong số đó là túi kìm khuẩn - Bactibag. Nhờ lớp phủ Bactiguard đặc biệt ở lớp bên trong của túi, công nghệ này hoạt động theo hai hướng:
- Ngăn chặn sự tăng sinh của vi khuẩn và làm giảm tác dụng của nội độc tố đối với tinh trùng khi vi khuẩn chết. Bằng cách này, chúng ta tăng thời hạn sử dụng của liều tinh trùng và bảo vệ chống lại vi khuẩn kháng kháng sinh.
- Tăng tính thấm của màng vi khuẩn, cho phép kháng sinh xâm nhập vào màng vi khuẩn. Điều này làm giảm số lượng chủng kháng thuốc trong liều tinh (hình 1).
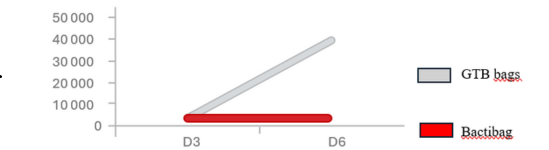
Ảnh 2. Sự phát triển của vi khuẩn ở túi GBT so với túi bactibag
Kết luận
Tinh dịch của lợn rất nhạy cảm với sự phát triển của vi khuẩn, đặc biệt khi được lưu trữ trong nhiều ngày. Các nguyên tắc cơ bản của sản xuất tinh dịch vệ sinh bao gồm thu thập tinh dịch với mức nhiễm khuẩn thấp nhất, giảm thiểu tiếp xúc của tinh dịch với tay nhân viên và môi trường, phát triển các tiêu chuẩn vệ sinh hiệu quả và giám sát liên tục các điểm kiểm soát quan trọng ở tất cả các giai đoạn của quá trình sản xuất liều.
Việc áp dụng các công nghệ mới như Collectis và Bactibag là hoàn toàn chính đáng và mang lại hiệu quả kinh tế nhanh chóng trong bối cảnh toàn cầu hóa năng lực sản xuất.
Tài liệu tham khảo
Althouse, G.C., Lu, K.G., 2005. Bacteriospermia in extended porcine semen. Theriogenology 63, 573–584. https://doi.org/10.1016/j.theriogenology.2004.09.031
Bresciani, C., Cabassi, C.S., Morini, G., Taddei, S., Bettini, R., Bigliardi, E., Ianni, F.D., Sabbioni, A., Parmigiani, E., 2014. Boar Semen Bacterial Contamination in Italy and Antibiotic Efficacy in a Modified Extender. Ital. J. Anim. Sci. 13, 3082. https://doi.org/10.4081/ijas.2014.3082
Kuster, C.E., Althouse, G.C., 2016. The impact of bacteriospermia on boar sperm storage and reproductive performance. Theriogenology 85, 21–26. https://doi.org/10.1016/j.theriogenology.2015.09.049
Maroto Martín, L.O., Muñoz, E.C., De Cupere, F., Van Driessche, E., Echemendia-Blanco, D., Rodríguez, J.M.M., Beeckmans, S., 2010. Bacterial contamination of boar semen affects the litter size. Anim. Reprod. Sci. 120, 95–104. https://doi.org/10.1016/j.anireprosci.2010.03.008
Sepúlveda, L., Bussalleu, E., Yeste, M., Torner, E., Bonet, S., 2013. How do different concentrations of Clostridium perfringens affect the quality of extended boar spermatozoa? Anim. Reprod. Sci. 140, 83–91. https://doi.org/10.1016/j.anireprosci.2013.04.013

