Caso clínico: Un caso excepcionalmente grave de encefalomiocarditis en un destete
20-may-2013 (hace 11 años 10 meses 13 días)
Descripción de la granja
Se trata de un destete (sito 2) que forma parte de una explotación que funciona en bandas donde se destetan 85-90 camadas cada tres semanas (900-1.000 lechones/destete). Los lechones llegan con una edad media de 26 - 28 días y con un peso medio de 7,4 - 7,6 kg.

Foto 1. Exterior de la nave.
Este destete funciona en flujo continuo – entra un nuevo lote cada tres semanas – con al menos dos grupos de lechones siempre presentes. La estructura consiste básicamente en tres salas adyacentes donde se realiza un todo dentro/todo fuera (TD/TF). Las corralinas, de unos 29 lechones, disponen de un suelo de slat de hormigón/plástico, alimentación a voluntad en comederos lineales y un número adecuado de bebederos tipo chupete. La ventilación es seminatural con extractores y con calefacción por aire caliente. La higiene y el manejo pueden calificarse como de nivel medio-alto.

Foto 2. Interior del destete.
El estatus sanitario es elevado (negativo a PRRS, Aujeszky, App, rinitis atrófica). Los lechones han sido vacunados frente a M. hyo en la sala de partos y, al llegar al destete, no suelen recibir ningún tratamiento. En el pasado se ha producido algún problema esporádico de meningitis o muerte súbita por Streptococcus suis que han sido solucionados medicando con amoxicilina en agua de bebida (alguna vez en pienso).
Hasta noviembre de 2011 los resultados técnicos de este destete fueron discretos en bajas (muertos y sacrificados) inferiores al 4%, crecimiento diario superior a los 450 g y un índice de conversión de 1,6 - 1,7.
Aparición de la sintomatología, tests laboratoriales y diagnóstico.
De repente, a finales de noviembre de 2011, el propietario detecta un aumento de la mortalidad con la pérdida de los "lechones más hermosos" del grupo de más edad (grupo A), que había entrado el 20 de octubre. Los lechones llevaban 30-40 días en el destete y, según el granjero, no se notaba ninguna sintomatología en particular pero cada día encontraban animales muertos.
En la primera visita los animales estaban activos, con buen aspecto y se alimentaban regularmente. No se apreciaban problemas evidentes de problemas respiratorios o entéricos. La necropsia, llevada a cabo en la propia granja, de dos animales encontrados muertos no permitió llegar a ninguna conclusión por la ausencia de lesiones patognomónicas o indicativas. Se tomaron muestras de estos dos animales (hisopos de meninges e intestinos, bazo y pulmón) que se mandaron al laboratorio donde se descartó la presencia de Streptococcus u otras bacterias que pudieran causar “muerte súbita” como por ejemplo E.coli hemolitico K88 (F4). Mediante PCR y exámenes serológicos efectuados sobre una muestra significativa de individuos de los dos grupos presentes se confirmó que el sitio seguía siendo negativo a PRRS y Aujeszky. Como precaución se prescribió un tratamiento con amoxicilina (20 mg/kg p.v.) en agua de bebida que no dio ningún tipo de resultado. En los días y semanas posteriores las pérdidas diarias, además de registrarse por grupo (el segundo grupo, B, había entrado el 10 noviembre), se registraron por corralinas, evidenciando que en ciertas corralinas... ¡la mortalidad había alcanzado el 50%!
Unos días después, durante la necropsia de otros individuos, se evidenciaron lesiones (necrosis) en el miocardio que podían ser indicativas de Encefalomiocardovirus (EMCV).
Por este motivo se enviaron otras muestras (lechones muertos y/o órganos) a la sede de Brescia del Instituto Zooprofilactico de la Lombardía y la Emilia Romana (IZSLER) que confirmaron la presencia de EMCV mediante PCR y cultivo celular. El departamento de Patología de la Facultad de Veterinaria de la Universidad de Parma realizó exámenes histológicos de los cerebros y corazones de otros tres lechones muertos. En los días inmediatamente posteriores se tomaron muestras de heces y orina de lechones de varias corralinas de ambos grupos para verificar si los animales podían ser excretores de virus.
|
|
|
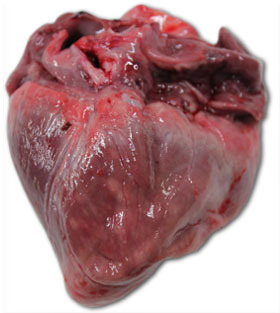
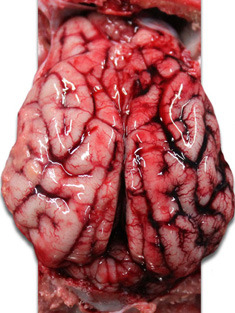
| Foto 3. Corazón de lechón muerto a los 40 días de vida. Se aprecia una gran dilatación del ventrículo derecho, con necrosis multifocal del miocardio (manchas blancas) y atrofia gelatinosa del tejido adiposo del epicardio. | Foto 4. Cerebro de lechón con congestión de los vasos venosos del hemisferio cerebral derecho. |
|
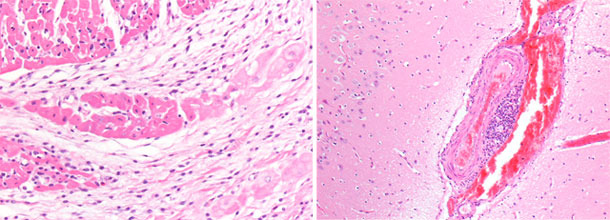
Foto 5. Cerebro de lechón. Engrosamiento ycongestión de los vasos venosos del hemisferio cerebral derecho. |
Foto 6. Miocardio, ventrículo derecho. Necrosis focal basófila del miocardio con microvacuolación. |
Resumen de los resultados
A pesar de todos los esfuerzos para controlar la propagación de la infección, las bajas – especialmente la muerte súbita de los mejores lechones – del grupo A siguieron hasta alcanzar el 25%. Este grupo, cuando se trasladó al engorde, todavía perdió un 7% más en las dos primeras semanas de engorde. Las pérdidas del grupo B estaban llegando a niveles similares (18%) cuando, el 1 de diciembre, llegó al destete el grupo C. La secuencia temporal de los grupos al destete y sus pérdidas se muestran en la siguiente gráfica.
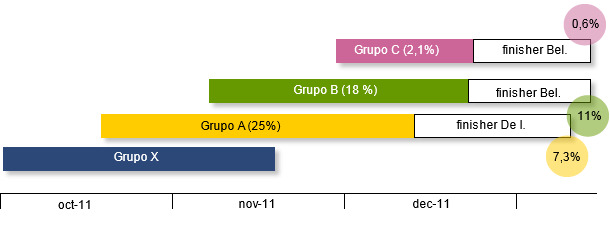
El laboratorio de patología de la Facultad de Veterinaria de Parma confirmó la presencia difusa de petequias asociadas a focos de decoloración en el miocardio, indicativa de una forma grave de miocarditis y una congestión difusa de las meninges.
Las diez muestras de heces y las tres de orina de los grupos A y B que fueron enviadas al IZSLER de Brescia resultaron todas positivas a EMCV.
Discusión
Los exámenes virológicos e histopatológicos confirmaron que este grave caso de muertes súbitas, registrados especialmente en los grupos A y B, eran debidos a la infección por Encefalomiocardiovirus. Según la literatura, las ratas y ratones son portadores y difusores de la infección. Pese a que no existen datos en este sentido, es probable que una única familia de ratas/ratones pueda desencadenar inicialmente el problema. En la granja en cuestión, de hecho, la desratización era muy cuidadosa y no había evidencias de una presencia masiva de roedores. No se observó presencia de excrementos y sólo después de una exhaustiva búsqueda se encontraron algunas huellas de ratones pequeños. Por lo tanto debe haber un periodo – seguramente breve – durante el cual los cerdos actúan de difusores/multiplicadores de la infección. Este periodo de tiempo es probablemente de 1 - 3 días, el periodo que transcurre entre el T0 – momento de la infección – y la muerte del animal. Esta hipótesis se confirmó por la detección de EMCV en las heces y orina y la concentración de la mortalidad en algunas corralinas concretas.
Conclusión
Debido a la elevada contaminación ambiental y a la elevada mortalidad (el grupo B había llegado al 18% en poco más de un mes desde su llegada) – aparentemente sin posibilidad de control – a mitad de diciembre se decidió vaciar completamente el destete, trasladando todos los lechones del grupo B y C a un engorde (sito 3) externo. Una vez vaciado, el destete se limpió a fondo utilizando agentes espumantes, se lavó con agua caliente a presión y se desinfectó. Pese a que el control ya era bueno, se revisaron y reforzaron todas las actuaciones de desratización y, como medida de seguridad adicional, todas las salas se sometieron a termonebulización. El sitio se mantuvo completamente vacío durante una semana. El 29 de diciembre llegó un nuevo grupo y, ni éste y todos los sucesivos, han vuelto a presentar ninguna sintomatología compatible con EMCV.
Notas epidemiológicas
La incidencia del virus de la encefalomiocarditis en cerdos domésticos y jabaliés en varios países europeos se ha descrito en diversos artículos. En una revisión de 2005, H. Maurice et al (2005), encontraron que la mayoría de brotes clínicos sucedieron en Bélgica (320), seguido de Italia (110), Grecia (15) y Chipre (6). Los brotes parecían estar agrupados en "áreas endémicas" con un aumento de los mismos en los meses de otoño e invierno. La seroprevalencia medida en las granjas afectadas clínicamente variaba considerablemente entre granjas (2-87%), entre varias edades (0-84%) y entre países. Datos procedentes de granjas sin clínica aparente mostraron que la infección subclínica por EMCV se encontraba tanto dentro (seroprevalencia 6-62%) como fuera (hasta un 17%) de las zonas endémicas de los países clínicamente afectados así como en países sin clínica de la enfermedad, Austria y Francia (3-5,4%). La seroprevalencia en los jabalíes variaba entre 0,6 y 10,8%, y en un estudio en Bélgica se encontró una prevalencia de infección por el virus de un 3,3%.