Resumen de la 51ª AASV: PRRS, DEP, gripe y PCV2
16-jun-2020 (hace 4 años 9 meses 15 días)
PRRS
• La industria porcina americana lleva tres décadas sufriendo la enfermedad con un impacto económico anual valorado en 664 millones de dólares, ascendiendo a 1.000 millones si se añaden las pérdidas indirectas. El coste estimado de un cuadro agudo en una granja de reproductoras media, es de 255 $/cerda y las pérdidas en granjas infectadas de forma crónica se estima en 74,16 $. Han hecho una estimación en la que, desde 1987, en EEUU han perdido 18.000 millones de dólares que es el equivalente a 14 meses de toda la producción de porcino y a 4,67-6,0 $/cerdo enviado a matadero en dicho periodo. En algunos cuadros clínicos describen mortalidades en lechones destetados de hasta el 78%. El 93 % de las cepas salvajes campo son del tipo 2 PRRSv, que son a su vez responsables de una mayor mortalidad en cerdos de engorde, comparativamente con las del tipo 1 europeo. Aún quedan muchas preguntas sin respuestas en esta enfermedad, sobre todo en cuanto a su control y eliminación. Consideran esencial poner el foco en las medidas de bioseguridad y el entrenamiento de los equipos humanos. En la compañía Hanor tienen 100.000 reproductoras en 7 estados y producen 1,7 millones de cerdos al año, donde desde 2015 sufrieron graves problemas por la entrada de nuevas cepas en su sistema productivo (1-8-4 y 1-7-4). Procedieron a incrementar las medidas de bioseguridad, lo que incluía: reducir el movimiento de animales dentro y entre granjas, así como el de personal dentro de las granjas, accesos específicos para trabajadores y visitas a granja, sala con ultravioletas para entrada de materiales, depósitos de cadáveres específicos aislados con separación de zona sucia-limpia para los trabajadores que los portan, eliminación de reposición con cerditas propias de granjas positivas y construcción de dos granjas nuevas para producir futuras reproductoras negativas, así como el control de las entradas de aire y suministro de agua como fuentes de entrada del virus, añadido al análisis de viremia al nacimiento y destete de lechones en base a muestras de sangre o fluidos orales conjuntamente con el cumplimiento de los procesos de manejo de McRebel que suponen un entrenamiento y formación específica a los trabajadores en la granja. Para ello, la comunicación regular de todos los procedimientos y la sensibilidad de las técnicas son críticas para cumplir con las expectativas, así como tener en cuenta que los mismos en cada granja pueden ser diferentes y cambiar en el tiempo.
• La aplicación de dos dosis de vacuna viva atenuada en cerdos de engorde sobre una muestra de 136.482 cerdos, demuestra una reducción de la excreción del virus campo y, por lo tanto, de su diseminación, sobre todo en granjas estables. El beneficio indirecto de la vacunación, además de la inmunidad, es la reducción de la exposición-transmisión del virus campo y los signos clínicos (ganancia media diaria, mortalidad).
• Desarrollan nuevas técnicas de diagnóstico a partir de heces (además de las de suero y fluidos orales) donde también encuentran anticuerpos con interés para conocer la supervivencia del virus en granjas, tanto de madres como de verracos. Los lechones infectados producen específicamente IgA e IgM, que se detectan bien por ELISA, estudiando la presencia de anticuerpos maternales (IgG) en infecciones activas o cerdas vacunadas a partir de suero. Prolongar las poblaciones virémicas tiene importantes implicaciones en su transmisión en la granja.
• Las radiaciones ultravioletas han sido utilizadas como desinfectantes desde 1910, habiendo demostrado su efecto de inactivación del virus PRRS después de una exposición de 10 minutos. Las cerditas de primer parto juegan un papel importante en el mantenimiento de la infección en granjas de reproductoras, siendo necesarios más estudios para conocer con más precisión el alcance equiparado a otros factores de granja como el método de exposición al virus en nulíparas, cepa vírica, rebrotes, estacionalidad y tiempos de estabilidad.
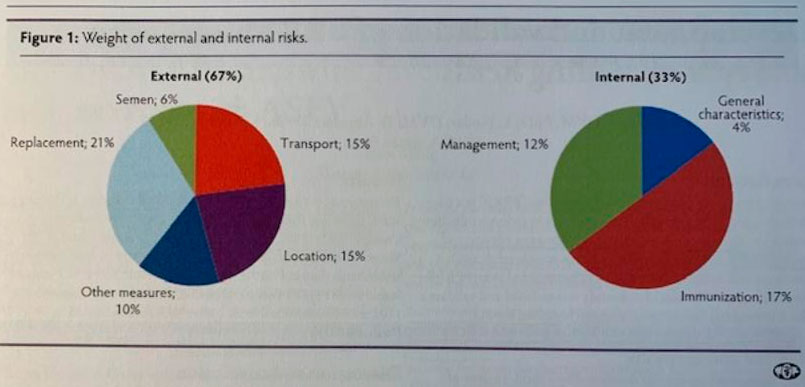
• Realizaron un estudio en 13 sistemas de producción, formados por 188 granjas en 15 estados, elaborando un modelo de predicción sobre 44 medidas de bioseguridad, demostrando que las cuatro más importantes para evitar cuadros de enfermedad son las cerditas de reemplazo, la densidad porcina en un radio de 4,83 km (3 millas), número de granjas de madres en dicho radio y la distancia a vías de comunicación públicas. Es palpable en numerosos trabajos la clara relación entre fallos en medidas de bioseguridad y la inestabilidad de las granjas frente al virus PRRS.
Diarrea epidémica porcina
• Está causada por un virus ARN del Orden Nidoviridae – Familia Coronavirus – Género Alphacoronavirus. Las pérdidas estimadas en un cuadro agudo son de 400 $/cerda. Varios estudios demuestran que el virus puede estar en los insectos, los cuales actúan como vectores, jugando un papel indirecto en la transmisión de la enfermedad dentro de la granja (contaminación piensos) y entre granjas. El virus puede sobrevivir 9 meses en los purines pudiendo ser infectivo al menos durante más de 28 días a diferentes temperaturas. La mínima dosis infectiva en pienso corresponde a un valor PCR Ct de 37.
• En EEUU circulan dos cepas: S-Indel y no S-Indel, siendo la primera menos virulenta. Poco se conoce de sus efectos virulentos en cerdos adultos de diferentes edades. La patogenicidad y respuesta de anticuerpos es edad dependiente.
Gripe porcina
• Las pérdidas por virus gripe en EEUU se estiman en 3,23 $/cerdo pudiendo incrementarse en casos de co-infecciones hasta los 10 y 18 $/cerdo.
• El virus continúa circulando endémicamente en la población porcina americana, reconociéndose tres serotipos predominantes: H1N1, H1N2 y H3N2. La circulación de múltiples variantes de un virus se ha documentado en una misma partida de cerdos, como consecuencia de lo cual continúan emergiendo nuevas cepas, lo que no sólo complica su control sino, además, su diagnóstico. El aislamiento del virus puede dificultarse también como consecuencia de un almacenamiento inadecuado, medio de conservación utilizado y transporte de las muestras derivado de la sensibilidad de su envoltura. Las muestras de hisopos nasales son efectivas para el aislamiento del virus. Se prescribe que las muestras se tomen de animales con signos clínicos agudos (fiebre, descargas nasales y toses) momento en el que se produce el pico de excreción, ya que en los días posteriores decrece y es más difícil detectar la clínica. La toma de muestra con toallitas nasales es más sensible que los hisopos nasales, siendo ambas técnicas de elección en granjas endémicas, recomendando la toma de 45 muestras por granja. El virus se inactiva estando expuesto a 37ºC durante dos días, igual que el virus de Aujeszky.
• El virus se transmite entre especies: aves, porcino y personas, siendo un candidato para producir pandemias. H3N2 tiene un elevado potencial de transmisión inter-especies ya que su ARN contiene fragmentos de las tres especies (un prototipo es el A/Swine/Texas/4199-2/98). Estudios previos han demostrado que las personas en contacto regular con los cerdos son los que tienen mayor riesgo de contraer la variante de esta cepa. El uso de la filogenética no solo tiene el potencial de decirnos cómo están cambiando los virus en el tiempo, sino cómo se mueven entre diferentes especies. En un estudio llevado a cabo durante 2015-18 en EEUU no encontraron genes H3 procedentes de los cerdos en personas hospedadoras, demostrando que los mismos se mueven más de las personas hacia los cerdos.
• Las vacunas pueden ser efectivas en reducir la prevalencia del virus al destete, pero su efecto depende en parte de incluir los antígenos adecuados del virus campo presente en las granjas, ya que tiene una elevada diversidad antigénica y genética que puede reducir la eficacia de dichas vacunas. MSD ha desarrollado la tecnología Sequivity para realizar el análisis de las secuencias sobre 12.000 virus gripe desde 2003 (1.800 secuencias disponibles en 2019) lo que permite conocer el impacto regional del virus, el movimiento entre granjas y las cepas de mayor riesgo de introducción, a efectos de tomar una acción proactiva en cuanto al tipo de vacunas a utilizar en cada sistema productivo. En su estudio realizado en dos periodos (diciembre de 2017 a diciembre de 2018 y desde éste a diciembre de 2019) han identificado importantes cambios, como la reducción de un 8% en cepas H1 gamma y delta 1ª, subiendo un 5% cada periodo las H1 alfa y pandémicas, mientras que la que más se ha incrementado es la H1 delta 2 en un 8,6 y 20,2% en cada periodo respectivamente. Son precisos más estudios para determinar si la sola mutación es la causa directa que da lugar a una reducción de las reacciones cruzadas o si son los cambios adicionales los que pueden influir en este descenso.
• En un estudio demuestran el papel importante de las cerdas nodrizas en la transmisión y persistencia del virus gripe en los lechones, tanto antes como después del destete.
PCV2 y PCV3
• El PCV3 se reportó por primera vez en 2015 en USA y se ha descrito posteriormente en 2017 en China, provocando inflamaciones sistémicas, miocarditis, fetos momificados, dermatitis y nefropatía. Este virus es ligeramente más grande que el PCV2 con tan sólo un 37 % de homología genética, responsable de neumonía, diarrea, desmedros, fallos reproductivos y patologías multisistémicas. El PCV1 se identificó como contaminante de células de cultivo PK-15, considerándose no patogénico en porcino. El PCV2 tiene 6 genotipos reconocidos (a-f) con una similitud en su secuencia de la ORF2 de entre 81-95 %. Hasta 2005 en EEUU el PCV2a fue el único reconocido, hasta que emergió el PCV2b en 2012, también a nivel mundial. Del PCV2c hay pocos aislamientos y sobre todo centrados en Brasil. El PCV2f ha sido recientemente detectado en China, Croacia e Indonesia. Es factible predecir que la evolución a nivel del genoma del PCV2 continuará, siendo difícil saber cuál será el curso de la enfermedad y la eficacia de las vacunas en el futuro. Algunos cuadros en granjas con el PCV3 dan lugar a un aumento de momificados, nacidos muertos, repeticiones y peor fertilidad a parto, mientras que los parámetros de producción en lechones y engorde se mantienen normales, por lo que algunos veterinarios en EEUU están prescribiendo la vacunación del efectivo reproductor en sábana dos veces con un intervalo de 3-4 semanas. El tiempo desde la vacunación hasta la negatividad por PCR en fluidos procesados es de 4 meses. Los valores de PCV3 PCR CT positivos tienen un rango de 25-27.
• Se estima que entre 20-35% de los virus PCV2 son recombinantes, llegando a precisar, en base a 4.500 publicaciones, la secuenciación de 1037 genomas completos de 41 países, que dicho dato es del 19,4% de media. Las co-infecciones con virus PRRS son bastante frecuentes e incrementan la severidad de la clínica, con mayor mortalidad, e incluso afectando a la respuesta inmunitaria de las vacunas de PCV y Mycoplasma hyopneumoniae. PCV2 causan más frecuentemente enfermedad clínica en cerdos entre 10 y 16 semanas de vida y las infecciones tempranas tienen lugar cuando el virus se transmite por el útero de las madres a los fetos, vía calostro o contacto directo antes del destete. Los problemas reproductivos por PCV2 suelen ser poco significativos. En granjas inestables se observan altos títulos de anticuerpos maternales en los lechones presumiblemente por infecciones activas aparentes en las madres, por lo que en estos casos y en algunas experiencias, las muestras de sangre en lechones jóvenes son una prueba diagnóstica de baja sensibilidad para determinar viremia y descartar que los mismos no están infectados. En dichos casos la vacunación en masa del efectivo reproductor estaría indicada. El estado de las cerditas de renuevo frente a PCV2 en cuanto a su nivel de viremia es importante para discernir su excreción y capacidad de transmisión vertical, por lo que está recomendado su control serológico en cuarentena.
• Las pérdidas económicas en casos agudas se estiman entre 20-30 $/cerdo.
Antonio Palomo

