¿Cómo sé si la reposición está protegida frente a PRRS?
18-nov-2019 (hace 5 años 4 meses 14 días)
La respuesta no es fácil, los resultados de ELISA y PCR no son 100% concluyentes, por lo que hay que aportar más seguridad con ciertas prácticas de manejo que se describen aquí.
Han pasado ya unos cuantos años desde que el PRRS llegó a nuestras explotaciones. Durante todo este tiempo hemos probado distintas estrategias para conseguir su control, llegando a la conclusión que éste no se consigue exclusivamente con el uso de vacunas, sino que es necesario que el manejo que se aplique no perpetúe el virus en alguna de las zonas de la granja, evitando que se reintroduzca en las gestaciones y generando problemas reproductivos, así como la producción de lechones virémicos que, más adelante, serán los responsables de problemas en fases de crecimiento. Una de las áreas que ha suscitado más atención, por la importancia que tiene para mantener esta estabilidad de la gestación, es la introducción de las cerdas de reposición.
Cuando la reposición proviene de un origen externo, la introducción de animales negativos al PRRS asegura que por esa vía no se va a introducir una nueva cepa del virus que pudiera romper la estabilidad conseguida, pero a la vez, plantea el problema de conseguir su correcta adaptación. Cuando la reposición procede de la propia explotación y ésta es estable, el riesgo está en que, con el tiempo, se convierta en negativa, lo que aumentaría el riesgo de volver a la inestabilidad. La solución a estos problemas es diseñar y aplicar un programa de adaptación que, bien mediante el contacto con el virus que circula en la granja, bien con el uso de vacunas o con la combinación de ambos, consiga que las cerdas primerizas desarrollen inmunidad a la enfermedad y superen su estado excretor tras el contacto con el virus. De este modo, al introducirlas en las gestaciones o área reproductiva de la granja no supondrán ningún riesgo para el mantenimiento de la estabilidad. Pero, cuando se aplican estas estrategias, las dudas que se plantean son siempre las mismas: ¿La reposición introducida está realmente protegida? ¿Seguro que ya no serán eliminadoras del virus cuando contacten con el resto de las cerdas?
Las técnicas disponibles a nivel de campo que nos indican la producción de anticuerpos (las técnicas de ELISA) no nos permiten realizar una correlación entre los resultados obtenidos y nivel de protección (López, 2007), tan solo nos indican que ha habido un contacto con el virus. A nivel experimental, hay otras técnicas que nos permiten conocer si se ha desarrollado inmunidad celular y otras que nos permiten conocer si los animales tienen o no capacidad de seroneutralizar el virus, ambas más relacionadas con la protección real. Pero desafortunadamente, estás técnicas son caras y complejas, de ahí que no se usen habitualmente. Las técnicas de ELISA poseen además un problema añadido y es que, dada la sensibilidad de la técnica, nos podemos encontrar con un porcentaje de animales (eso si, pequeño) que a pesar de haber contactado con el virus nos den un resultado negativo (falsos negativos). Por lo tanto, en la práctica, lo que haremos será realizar una serología utilizando una prueba de ELISA sobre un porcentaje significativo de las primerizas. Lo que queremos comprobar con ello es que el grupo es positivo. Se considerará positivo, incluso, teniendo algún resultado negativo (siempre que se encuentre dentro de los límites de sensibilidad de la prueba realizada).
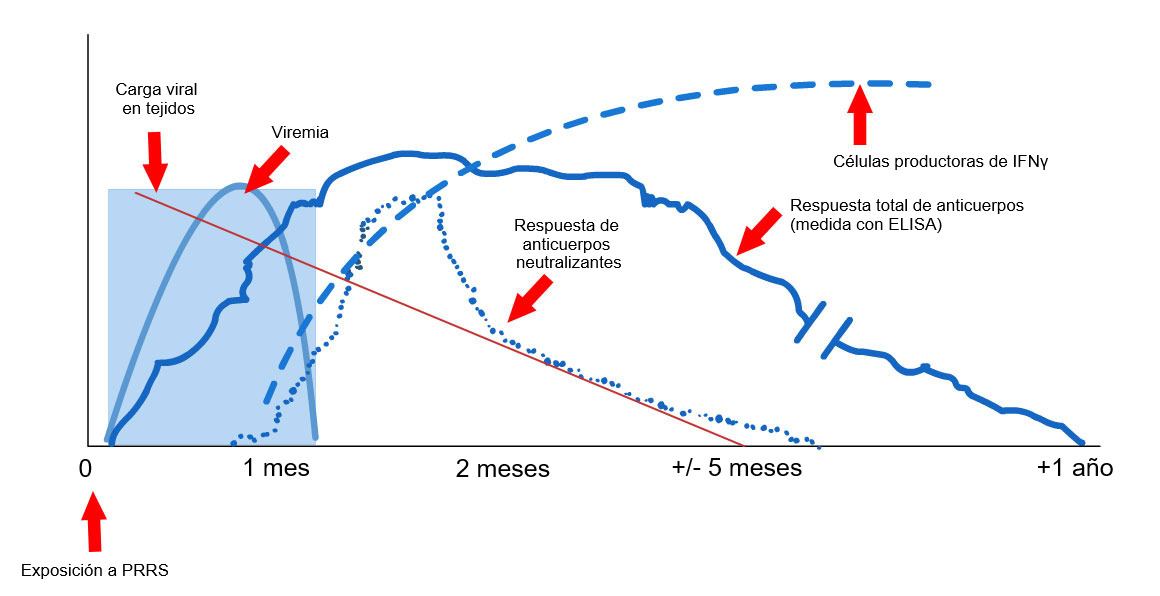
Asegurar que las cerdas ya no eliminan el virus parece más fácil, considerando que hoy disponemos de técnicas de PCR que nos permiten detectar cantidades muy pequeñas de partículas víricas. Sin embargo, en el caso de los animales infectados por el virus del PRRS la viremia o la presencia del virus en sangre no durará más de 4-6 semanas, en la mayoría de los casos, pero sabemos que animales sin virus en sangre pueden ser portadores de virus a nivel tonsilar durante períodos mucho más largos (Horter, et al. 2001). Para saber si el virus se encuentra en tonsilas hay que realizar una biopsia de éstas, lo que no es práctico. Este es el motivo por el que, a pesar de su limitación seguimos usando el PCR como técnica que nos aporta una aproximación al estado de portador. Estos PCR los podemos realizar a partir de muestras de sangre o de fluidos orales y, siempre, sobre un porcentaje significativo de la población que vayamos a introducir.
En la práctica, lo que queremos es tener la reposición positiva a ELISA y negativa a PCR antes de ponerlas en contacto con el resto de las reproductoras. Pero, conociendo las limitaciones de las técnicas, hay que intentar que el manejo que se implante aporte un extra de seguridad. Así, por ejemplo, se recomiendan adaptaciones suficientemente largas (unas 12 semanas) para asegurar el contacto y el cese de la excreción, y un manejo separado de las primerizas cubiertas, por lo menos durante el primer tercio de la gestación, con el objetivo de tamponar la posible presencia de una primeriza eliminadora en el interior del grupo.
