Caso clínico: Trombocitopenia púrpura
04-dic-2017 (hace 7 años 3 meses 27 días)
Introducción
Se trata de una granja comercial de ciclo cerrado con 400 cerdas en Irlanda del Norte.
La unidad es negativa a influenza porcina y PRRS.
El protocolo de vacunación utilizado se ilustra en la Tabla 1.
Tabla 1. Programa de vacunación
| VACUNA | NULÍPARAS | CERDAS | VERRACOS | LECHONES |
| Parvovirus | Inyección de 2 ml en la selección | Inyección de 2 ml 2 semanas después del parto | ||
| Erisipela | Inyección de 2 ml en la selección y 2 semanas antes de la cubrición | Inyección de 2 ml 2 semanas después del parto | Inyección de 2 ml dos veces al año | |
| Colibacilosis | Inyección de 2 ml 6 y 2 semanas antes del parto | Inyección de 2 ml 2 semanas antes del parto | ||
| PCV-2 | Inyección de 2 ml 3 semanas antes de la cubrición y 3 semanas antes del parto | Inyección de 2 ml 3 semanas antes del parto | Inyección de 2 ml dos veces al año | |
| Neumonía enzoótica | 1 ml a los 7 días y al destete |
Las nulíparas son criadas en la explotación. Las nulíparas y las cerdas se cubren por inseminación artificial procedente de un solo origen.
Historia
El ganadero contactó con el veterinario debido a un aumento de hemorragias y hematomas subcutáneos en la piel de varios lechones en ocho camadas diferentes. No se atribuyeron muertes al problema.
La unidad había experimentado este problema durante los últimos 3 años, pero no en la misma medida que ahora. Los signos clínicos aparecen de repente en unas pocas camadas y luego desaparecen durante períodos de tiempo.
Investigación
Investigación clínica
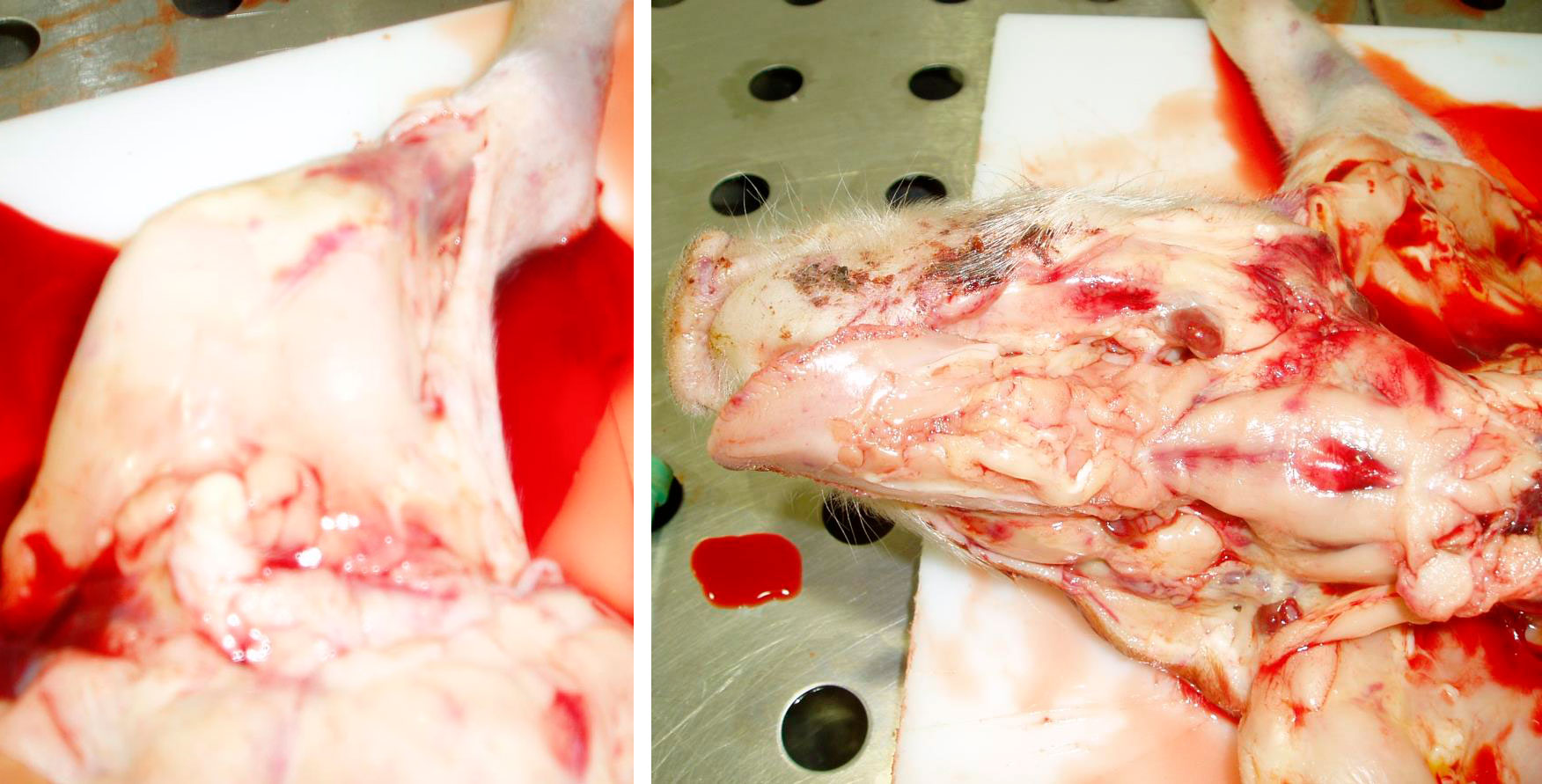
Durante la visita a la granja, 28 lechones de 8 camadas diferentes tenían hemorragias subepiteliales diseminadas (Figuras 1, 2, 3, 4 y 5). Los lechones desarrollaban los signos clínicos a partir de los 7 días de edad, después de haber nacido normales. Los lechones afectados continuaban mamando y no padecían ningún retraso en el crecimiento. No todos los lechones de las camadas afectadas presentan signos clínicos externos.

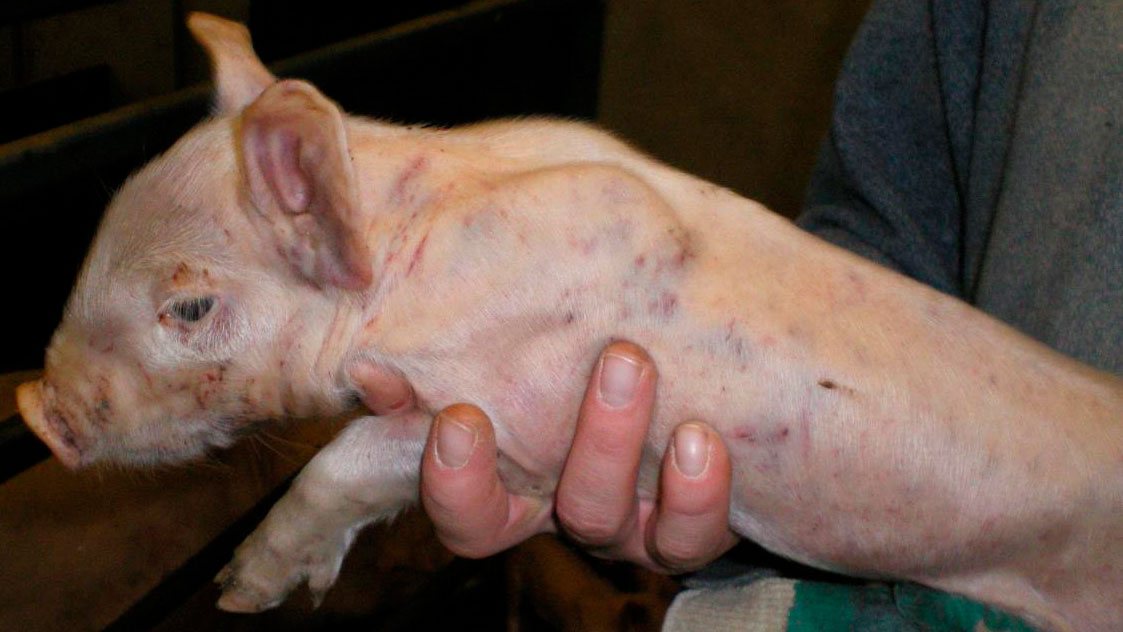
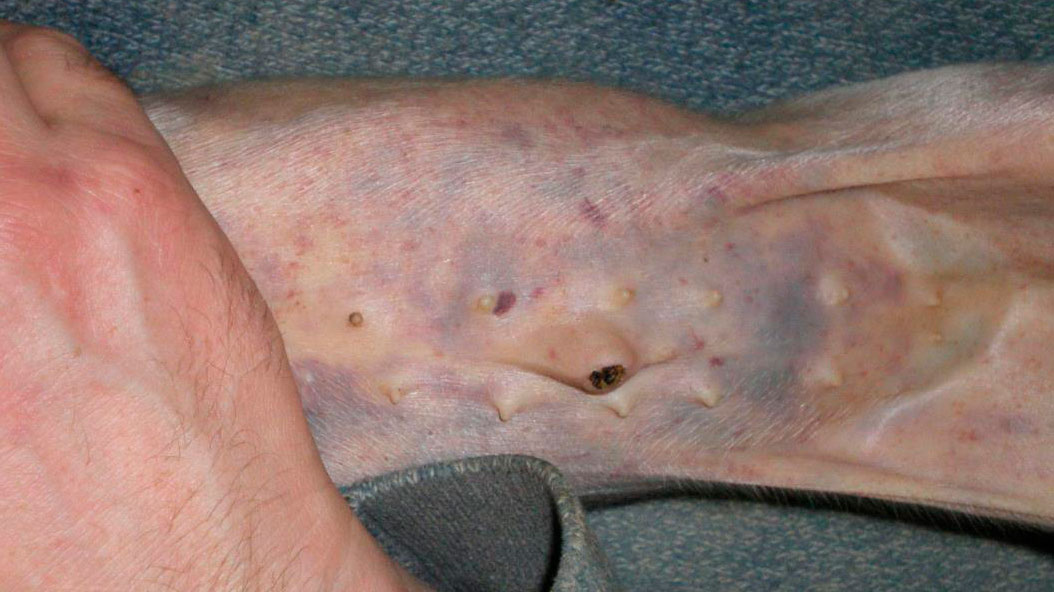
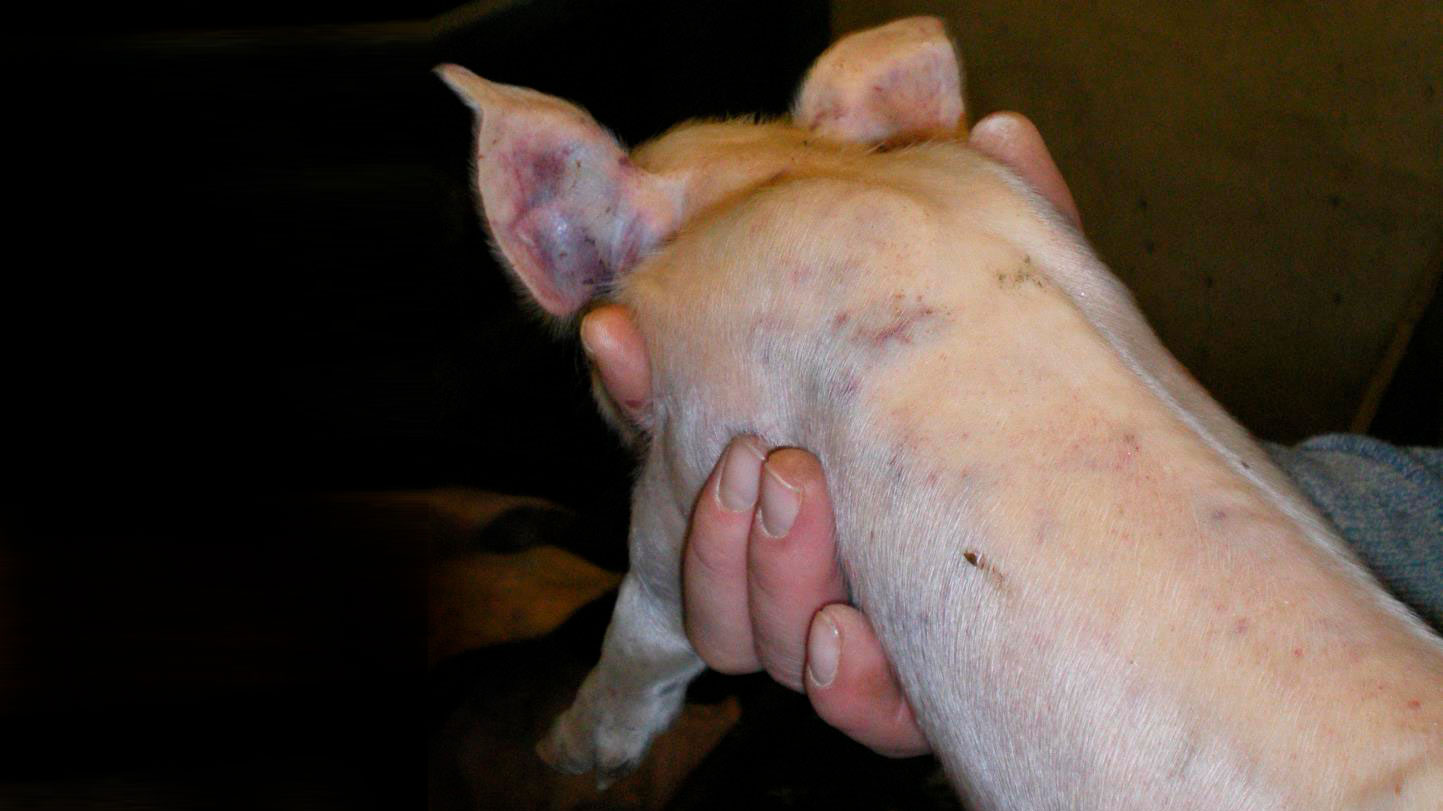
En el momento de la visita, se estaban cortando las colas a los lechones. El sangrado de la cola era profuso y había un retraso en la coagulación (Figuras 1 y 2).
No se detectó fiebre tras tomar la temperatura rectal de 10 lechones afectados.
Investigaciones laboratoriales
Un lechón muerto recientemente y otro lechón vivo y afectado de 7 días de edad se enviaron al laboratorio. Se solicitó recoger en el laboratorio una muestra de sangre heparinizada para hematología. Los resultados de laboratorio se resumen en la Tabla 2.
Los análisis de hematología y bioquímica no pudieron realizarse como consecuencia de que las sangres, recogidas en el laboratorio, estaban coaguladas.
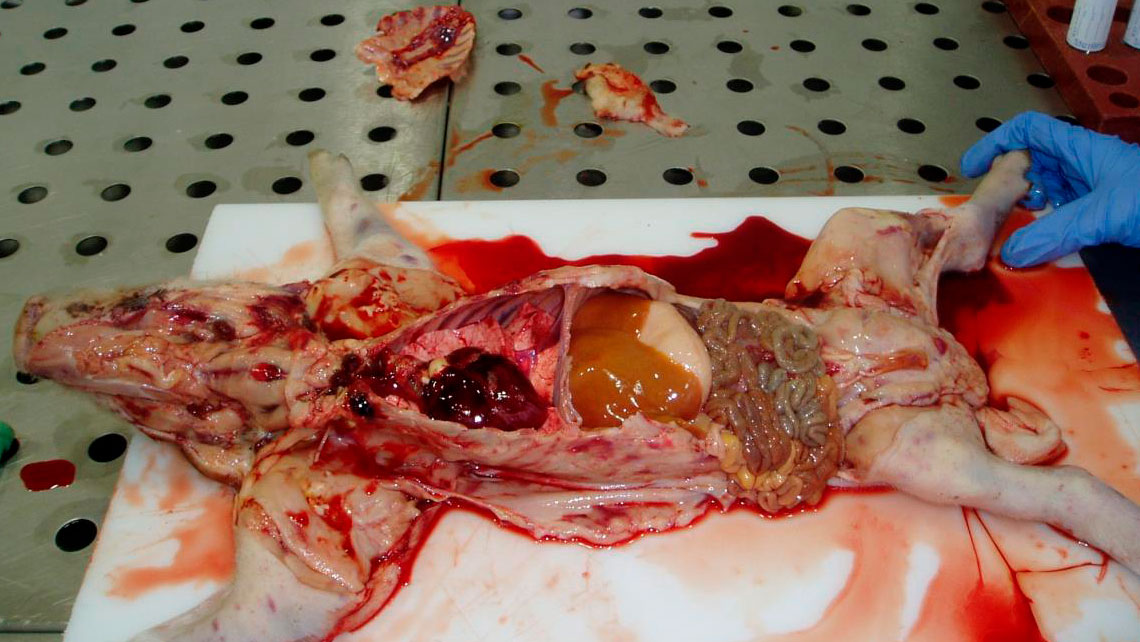
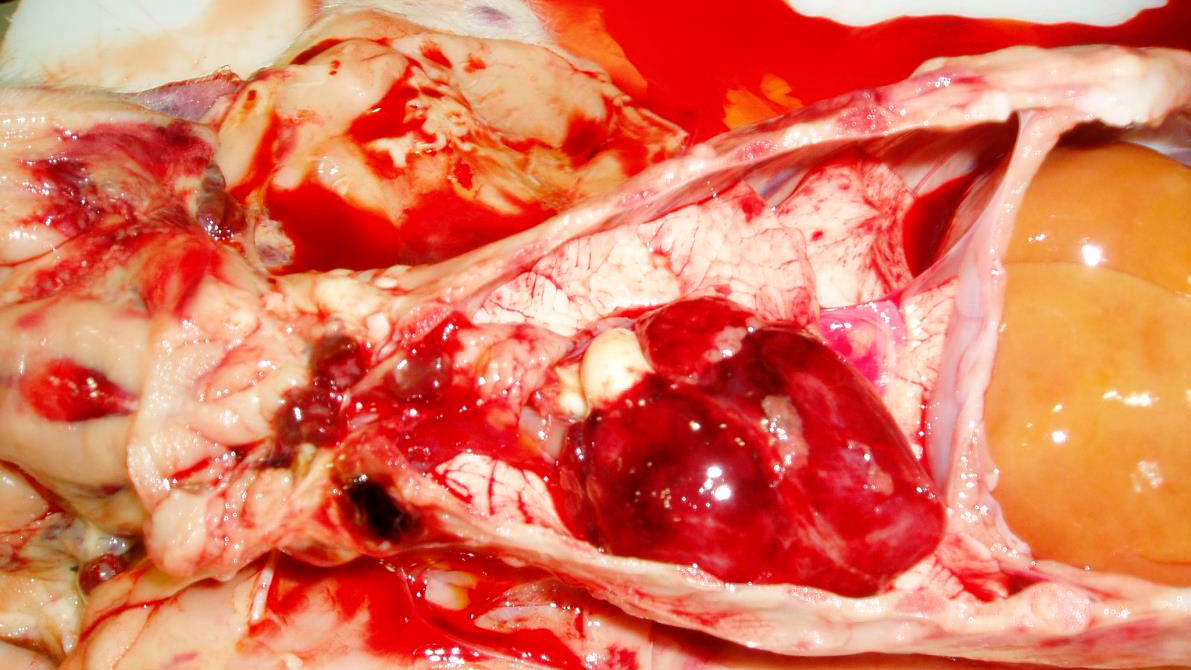
La evidencia fotográfica post mortem se muestra en las Figuras 6, 7, 8 y 9.
Tabla 2. Resultados de laboratorio de los dos lechones de 7 días de edad.
| Post mortem | Histología | Inmunofluorescencia | Bacteriología | |
| LECHÓN 1 (Muerto) | • Hemorragias subepiteliales superficiales generalizadas con algunas petequias en la canal. • Sangre diluida y acuosa. • Algunas hemorragias petequiales en el corazón. • Riñón pálido y con hemorragias petequiales. • Hígado pálido e ictericia. |
• No se detectaron anomalías significativas. | • Negativo a PPC y PCV-2. | • No se aislaron bacterias significativas. |
| LECHÓN 2 (Vivo) | • Hemorragias subepiteliales generalizadas en la canal. • Sangre diluida y acuosa. • Hemorragias petequiales en riñón y pulmón. |
• No se detectaron anomalías significativas. | • Negativo a PPC y PCV-2. | • No se aislaron bacterias significativas. |
PPC = Peste Porcina Clásica
PCV-2 = Circovirus Porcino tipo 2
Diagnóstico diferencial
Según las investigaciones clínicas y laboratoriales, se realizó el siguiente diagnóstico diferencial:
- Trombocitopenia púrpura
- Deficiencia de hierro
- Deficiencia de vitamina K (intoxicación por rodenticida)
- Peste porcina clásica (PPC)
- Circovirosis porcina (PCV-2)
Los agentes virales, tales como el virus de la PPC y PCV-2, se descartaron por la falta de signos clínicos compatibles con estas enfermedades y los resultados negativos de la prueba de inmunofluorescencia.
La deficiencia de hierro se descartó debido a las inyecciones de hierro dextrano que se administran de forma rutinaria a todos los lechones por vía intramuscular a los 2 días de vida y a las hemorragias subepiteliales diseminadas.
La deficiencia de vitamina K (intoxicación por rodenticida) no puede excluirse del diagnóstico diferencial sin hematología. Como se menciona en 4.2., la muestra de sangre recogida se coaguló y no pudo realizarse ningún análisis de hematología/bioquímica. No se puso veneno para ratas en las salas de parto.
Se sugirió un diagnóstico de trombocitopenia púrpura en base a la historia y las investigaciones clínicas y de laboratorio.
Programa de control
Se realizaron adopciones cruzadas de las camadas afectadas con otras cerdas.
Se recomendó que las cerdas que producían las camadas afectadas fueran eliminadas o se cubrieran con un verraco diferente.
Respuesta al programa de control
Algunos de los lechones afectados transferidos a otras cerdas, murieron a los pocos días.
Ningún otro caso ha sido descrito por el ganadero desde entonces.
Discusión
La trombocitopenia púrpura es una hipersensibilidad de tipo II (o hipersensibilidad de tipo citotóxico) en la que se forman autoanticuerpos contra los trombocitos. Esto resulta en su reducción y diátesis hemorrágica como signo clínico asociado. Estos autoanticuerpos pueden surgir debido a transfusiones de sangre, el uso de vacunas que contienen productos sanguíneos, o en cerdas multíparas que desarrollan anticuerpos contra los aloantígenos compartidos por el padre y el feto. En este último caso, no se espera que aparezcan signos clínicos en la cerda ya que solo produciría anticuerpos contra antígenos de alotipo de superficie celular que no se encuentran en sus células (Straw et al., 1999). A diferencia de los bebés y cachorros de perro, no se transfieren anticuerpos a través de la placenta desde la cerda hasta sus lechones antes del nacimiento. Los lechones nacen en un estado vulnerable sin anticuerpos humorales o asociados a la mucosa ni inmunidad adquirida mediada por células (Muirhead et al., 1997a). Esto explicaría por qué la gestación no se detiene. La ingestión de estos autoanticuerpos en el calostro y su absorción por parte del lechón da como resultado una disminución en los niveles circulantes de trombocitos en aproximadamente 200x109/l a los 2 días de edad (normalmente mayor, 250-300x109/l). La recuperación tiene lugar en 400x109/l a los 5 días y a partir del 9º día disminuye a un nivel de 50x109/l cuando la púrpura aparece. Los megacariocitos y otras células en la médula ósea se ven afectados y no se reemplazan los trombocitos circulantes (Taylor, 1995).
Las transfusiones de sangre y las vacunas que contienen productos sanguíneos, como la vacuna al cristal violeta contra la peste porcina (Smith et al., 1990), no se usaron en esta granja. Por lo tanto, la única opción era que las cerdas multíparas habían desarrollado anticuerpos contra los aloantígenos compartidos por el padre y el feto. Las camadas afectadas provenían de un verraco Large White. Todas las cerdas que habían producido una camada afectada tenían más de una paridad. Según Taylor (1995), para que tenga lugar la enfermedad, el tipo de trombocito del verraco debe diferir del de la cerda y esta debe haber tenido al menos una camada previa con un verraco de ese tipo de trombocito. En este caso las cerdas afectadas habían sido I.A. con este verraco en una camada anterior. Taylor (1995) afirma que este problema es más frecuente en cerdos Large White y Landrace y es particularmente común cuando se usa un verraco Large White con una cerda Landrace. En este caso, se utilizó un verraco Large White para cubrir cerdas Landrace o Landrace x Large White. Por esta razón, se recomendó cambiar la I.A., lo que mejoró la situación sin la necesidad de desviejar las cerdas o el verraco. Desafortunadamente, el recuento de trombocitos no pudo realizarse debido a la coagulación de la muestra de sangre recogida en el laboratorio. Otra alternativa habría sido recoger la sangre en la granja. Sin embargo, desde entonces no se han producido más casos.
No todos los lechones de las camadas afectadas mostraron signos clínicos. De acuerdo con Straw et al. (1999) y Taylor (1995), el efecto aleatorio de la condición en una camada parece estar relacionado con el crecimiento y la ingestión de calostro, siendo los lechones bien desarrollados que han mamado más calostro los que se han visto más gravemente afectados. Todos los animales afectados tenían buena condición corporal, estaban bien desarrollados y no perdían el apetito.
Los lechones afectados parecen normales al nacer (Straw et al., 1999). Diferentes autores han reportado distintos tiempos para la primera manifestación de la enfermedad, 7 – 21 días de edad (Muirhead et al., 1997b), 10 – 20 días de edad (Straw et al., 1999) o 14 – 30 días de edad con un menor pico a los 3 días de edad (Taylor, 1995). En este caso, la enfermedad apareció a los 7 días de edad, como reporta Muirhead et al. (1997b).
Puede darse la muerte del animal sin signos clínicos (Muirhead et al., 1997b; Taylor, 1995). Si se observa detenidamente la piel de los lechones muertos, se perciben hemorragias en todas las contusiones, mordiscos o traumatismos (Muirhead et al., 1997b). En este caso no se pudo correlacionar las muertes súbitas causadas por trombocitopenia púrpura y otras causas de muerte, como el aplastamiento. Sin embargo, los lechones afectados a menudo son pálidos y se observa una piel púrpura, con marchas, hemorragias principalmente en el vientre, y marcas claras de arañazos. Las mucosas generalmente son pálidas y no hay fiebre (Straw et al., 1999; Taylor, 1995). Se observan hemorragias de diferentes tamaños en el epicardio, el miocardio, la pleura, las articulaciones y los músculos esqueléticos. Todos los linfonodos están llenos de sangre (Muirhead et al., 1997b; Taylor, 1995). Todas estas características fueron consistentes con el cuadro clínico visto en este caso.
La castración durante el período de trombocitopenia púrpura puede aumentar en gran medida la tasa de mortalidad (Straw et al., 1999). La castración no se realizaba en esta granja. Sin embargo, como se indica en la investigación clínica, después de cortar las colas el sangrado era profuso y había retraso en el tiempo de coagulación.
La incidencia de esta problemática es baja, menos del 1% según Taylor, 1995.
El diagnóstico se realiza por un cuadro clínico y post mortem característico (Muirhead et al., 1997b; Taylor, 1995). Se puede confirmar el diagnóstico mediante recuento de plaquetas (Taylor, 1995). En este caso, se siguieron todos estos procedimientos. Sin embargo, los recuentos de plaquetas no pudieron realizarse por las razones indicadas en las investigaciones de laboratorio.
No se conoce otro tratamiento distinto de una buena lactación (Muirhead et al., 1997b; Taylor, 1995). El uso de vitamina K no se ha reportado (Taylor, 1995) pero sería interesante usarlo en futuros brotes. En las primeras etapas de la enfermedad, vale la pena fomentar la adopción cruzada de las camadas para eliminar la exposición a cualquier anticuerpo persistente en la leche de la cerda (Muirhead et al., 1997b), como se llevó a cabo en este caso. La alimentación artificial también se puede practicar (Taylor, 1995). No obstante, la mortalidad es bastante elevada.
La trombocitopenia púrpura se ha descrito en otras especies, como en ganado bovino y ovino como consecuencia de la intoxicación por helechos (Barlow, R., 1983). En humanos se produce como consecuencia de una etiología infecciosa, autoinmune, maligna o idiopática (Wei, A. et al., 2007).
Cuando una cerda produce una camada afectada, debe ser eliminada o cubierta con un verraco distinto en la siguiente gestación (Muirhead et al., 1997b; Taylor, 1995). En este caso, se optó por cubrir a las cerdas afectadas con un verraco diferente en vez de sacrificarlas. Esta medida ha tenido éxito ya que no se han notificado más casos de trombocitopenia púrpura desde entonces.
