El sistema inmunitario y la inmunidad en el cerdo: Inmunidad humoral específica (1/2): tipos y estructura de Ig
17-oct-2017 (hace 7 años 6 meses 2 días)
Los anticuerpos (Ab) o inmunoglobulinas (Ig):
- Son producidos por linfocitos B estimulados por antígenos y diferenciados en células plasmáticas (células secretoras de anticuerpos, en inglés ASC: Antibody Secreting Cells)
- Secretados en fluídos corporales extracelulares.
- Capaces de unirse y atacar a patógenos extraños, neutralizándolos y eliminándolos a través de múltiples mecanismos
El monómero de immunoglobulina tiene un peso molecular de 150-180 kDa y tiene una forma parecida a una Y (Figura 1).
MOSTRAR_ANIMACIO[562]
Figura 1. Estructura general de una inmunoglobulina.
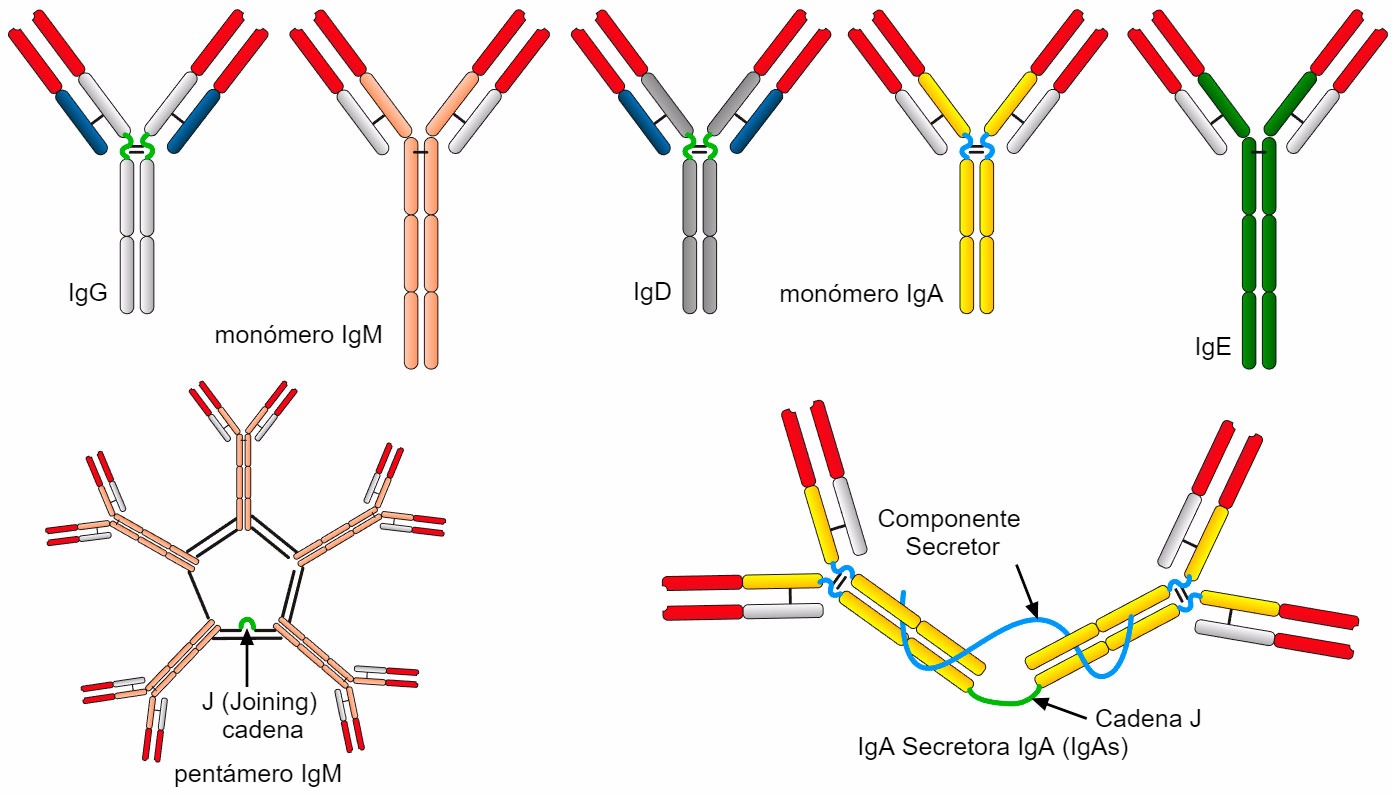
La estructura típica de Ig consiste en dos cadenas pesadas (H: heavy) y dos cadenas ligeras (L: light) unidas por puentes disulfuro. Ambas cadenas constan de dos partes, una región constante (C), y una región variable (V).
Las cadenas H y L tienen regiones o dominios donde la proteína se pliega para formar un área globular, denominada VH, CH y VL, CL, respectivamente. Las cadenas pesadas están formadas por una parte variable (VH) y tres (para IgG e IgA) o cuatro (para IgM e IgE) dominios constantes denominados CH1, CH2, CH3 y CH4. La cadena ligera puede ser del tipo λ o κ y está formada por dos dominios, uno variable (VL o VK) y otro constante (CL o CK). Los dominios VH y VL tienen regiones altamente variables denominadas CDRs (regiones determinantes de la complementariedad) que son el sitio de unión para un antígeno específico.
Hay una región bisagra entre CH1 y CH2 que permite la flexibilidad de las moléculas de Ig. La digestión de esta región bisagra con proteasas resulta en dos fragmentos Fab que contienen el sitio de unión del antígeno y un Fc (fragmento cristalizable) implicado en las funciones del anticuerpo.
Los dominios CH2 y CH3 son los sitios de unión para los receptores Fc, mientras que los dominios CH1-CL se unen al fragmento complementario C4b y el dominio CH2 se une al factor C1q del complemento.
Una bacteria posee diferentes epítopos superficiales; durante una infección se producirán diferentes anticuerpos y cada anticuerpo se unirá a sus epítopos específicos sobre el patógeno.
Las diferentes secuencias de aminoácidos de la región constante de la cadena pesada caracterizan a las diferentes clases de anticuerpos o isotipos (Figura 2): IgD (cadena pesada δ), IgM (cadena pesada μ), IgG (cadena pesada γ), IgA (cadena pesada α) e IgE (cadena pesada ε). Las IgM son secretadas como pentámeros y las IgA como dímeros secretores.
Se han descrito algunas subclases de Ig con diferentes cadenas pesadas, principalmente entre las clases IgG e IgA.
Los diferentes anticuerpos son los efectores de la inmunidad humoral frente a agentes infecciosos y, por tanto, están presentes en altas concentraciones en suero y en otros fluidos biológicos (secreciones mucosas (por ejemplo saliva), leche, calostro, etc.). El papel defensivo de los anticuerpos se debe a diferentes mecanismos (descritos en la segunda parte del artículo)
Las IgG son inmunoglobulinas con un peso molecular de aproximadamente 108 kDa. Las inmunoglobulinas IgG están en mayor cantidad en el suero y en los espacios extravasculares.Las IgG están principalmente involucradas en la respuesta defensiva sistémica. Son eficaces en la neutralización de virus, en la interacción con la fracción C1 del complemento y en la activación de la cascada del complemento con opsonización y fagocitosis de patógenos. Además, promueven la muerte de células infectadas mediante citotoxicidad celular mediada por anticuerpos (reacciones ADCC -Antibody Dependent Cell-Mediated Cytotoxicity). El cerdo tiene seis subclases de IgG, de IgG1 a IgG6.
Los monómeros de IgM con un peso molecular de aproximadamente 108 kDa están unidos a la superficie de las células B y tienen un papel como BCR (Receptor de Células B) para el reconocimiento de antígenos. Las IgM secretadas presentan una forma de pentámero con una forma circular en la que se juntan cinco subunidades de monómero unidas por enlaces disulfuro y una cadena J; esta forma pentamérica tiene aproximadamente 900 kDa de peso molecular.
La IgM es la primera inmunoglobulina sintetizada cuando hay un primer contacto con el antígeno. Se secreta principalmente como parte de la respuesta inmune humoral primaria para una primera e importante defensa contra infecciones virales y bacterianas. La presencia de IgM específica contra un patógeno en el suero indica infección reciente / aguda. También se secretan durante la respuesta secundaria, pero en una cantidad menor. En esta forma, las regiones Fc están en el centro con diez sitios de unión al antígeno en la periferia.Las IgM son capaces de unirse a más moléculas del fragmento C1 para la vía clásica y son altamente eficientes en la activación del complemento para la opsonización, así como en la neutralización y aglutinación de virus.
Los llamados anticuerpos IgM naturales (NA: "Anticuerpos Naturales" - IgM) son producidos por algunos subconjuntos de linfocitos B que pueden estar involucrados como defensa de primera línea contra la propagación sistémica de agentes infecciosos.
La IgA es la clase predominante de Ig en las secreciones (saliva, moco, lágrimas, calostro, leche) en las superficies mucosas y previene la penetración y colonización de patógenos.
Las IgE son inmunoglobulinas de aproximadamente 190 kDa de peso molecular y está presente a baja concentración en sangre. Las inmunoglobulinas IgE están específicamente implicadas en la hipersensibilidad tipo I y en la defensa contra los parásitos.
El monómero IgD tiene un papel principal como BCR.
