Control de la microbiota intestinal y de la susceptibilidad a patógenos mediante selección genética
19-jul-2016 (hace 8 años 8 meses 12 días)
La resistencia bacteriana a los antibióticos es un problema global. Un uso masivo de antibióticos en la producción porcina industrial es una de las causas del actual aumento de bacterias resistentes. Las infecciones intestinales en particular precisan grandes cantidades de antibióticos, es por ello que la mejora de la salud intestinal de los cerdos tendrá un impacto importante en el consumo de antibióticos.
La vida microbiana en los intestinos juega un papel clave en la salud intestinal
La salud intestinal depende de muchos factores tales como la digestión y la absorción de nutrientes, las enfermedades gastrointestinales y la composición de la microbiota. La microbiota intestinal es una comunidad compleja y dinámica de más de 1000 especies diferentes y es fundamental para la salud intestinal de los mamíferos. La microbiota tiene el potencial de modular muchos de los factores que afectan la salud. La mayoría de las bacterias proporcionan grandes beneficios al huesped, incluyendo la degradación de nutrientes, la activación de genes del huesped que están involucrados en la absorción de nutrientes, la suplementación de vitaminas, el desarrollo inmune y la prevención de la colonización por patógenos. Es por ello que mantener una composición equilibrada de estos habitantes del intestino es una clave importante para el control de la salud intestinal.
La colonización del intestino depende de una gran variedad de factores genéticos y ambientales, que hemos emepezado a conocer recientemente. Necesitamos mejorar nuestros conocimientos sobre cómo se controla la colonización, y los mecanismos moleculares en que se basa, para poder modular la microbiota en beneficion de la salud intestinal.
La genética es importante para controlar qué microorganismos habitan en el intestino
La genética tiene el potencial de regular la colonización bacteriana y, en particular, una variación natural del gen α1,2-fucosiltransferasa 1 (FUT1) parece tener un papel importante. El polimorfismo de FUT1 controla las infecciones por E. coli enterotoxigénica con fimbrias F18 (ETEC F18) (Meijerink et al. 2000). ETEC F18 es responsable de una parte importante de las infecciones intestinales, particularmente en cerdos recién destetados. Un mejor conocimiento sobre la forma en que esta variación genética mejora la salud intestinal tendría un gran valor y podría ayudar a reducir el uso de antibióticos en la producción porcina.
FUT1 controla el ensamblaje de estructuras importantes para la colonización bacteriana
FUT1 es un enzima que interviene en la formación de glúcidos específicos. Todas las células tienen moléculas de reconocimiento específico en su superficie que les permiten interaccionar con otras células. Generalmente, estas moléculas son azúcares específicos que están unidos a proteínas o lípidos determinados. Tales azúcares también son muy importantes para la vida microbiana en el intestino y sirven tanto como puntos de fijación de los microorganismos a la pared intestinal como de fuente nutricional para los microorganismos (Fig. 1). Un cambio en la disponibilidad de estos azúcares podría muy bien tener consecuencias fatales para algunas bacterias.
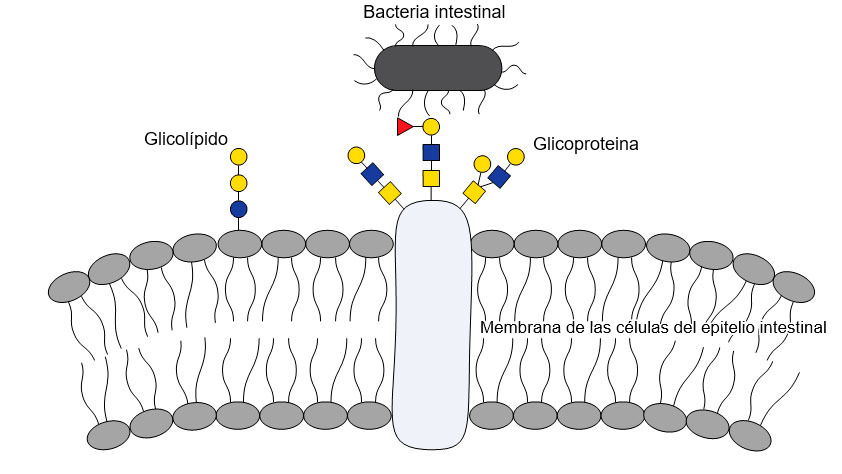
Figura 1: Las interacciones entre bacterias y glicanos son importantes para la colonización del intestino, ya que las moléculas de la bacteria se adhieren a las células del huesped mediante glicanos específicos.
Un estudio reciente de nuestro equipo mostró que una variante específica del gen FUT1 controla la expresión de ciertos glúcidos con fucosa en el intestino (Hesselager et al. 2016). Estas estructuras de glúcidos específicas se conocen también como antígenos del grupo histo-sanguíneo, habiéndose observado previamente que afectan a la fijación de las bacterias (Gagneux and Varki 1999), pero lo que no se había demostrado previamente es que estos azúcares específicos estuvieran ligados a las proteínas de las células intestinales. Por ello, nuestros hallazgos corroboran que la cadena fucosa-azúcares-proteinas proporciona oportunidades importantes para manipular la colonización bacteriana del intestino.
¿La selección genética puede mejorar la salud intestinal del cerdo?
Hemos establecido una sucesión de eventos que relacionan una variación genética natural con cambios específicos en las moléculas de azúcares del intestino, que a su vez tienen un impacto directo en la salud y la susceptibilidad a patógenos (Fig. 2). Este conocimiento abre la puerta a una mejor comprensión de cómo la genética puede influir sobre la salud intestinal y a que ésta se pueda mejorar a través de la selección.
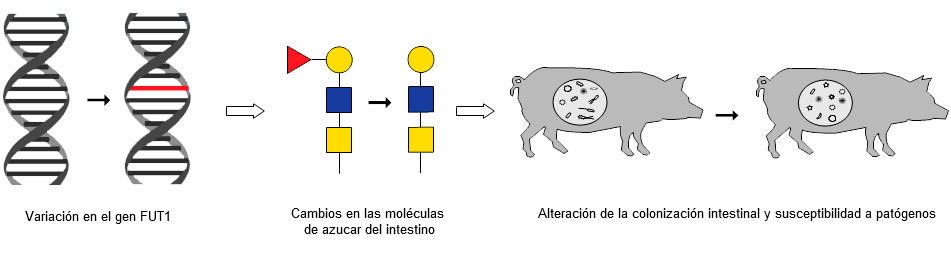
Figura 2: La sucesión de eventos que relaciona una variación conocida del gen FUT1 con cambios en las moléculas de azúcar en el intestino y con alteraciones en la colonización intestinal y susceptibilidad a patógenos.
La variación genética de FUT1 proporciona resistencia a ETEC F18, sin embargo, teniendo en cuenta que los azúcares intestinales se usan comunmente como puntos de fijación de otros microorganismos o como fuente nutricional, otros microorganismos con papeles importantes en la salud animal también pueden resultar afectados. Esto significa que, para comprender plenamente el impacto de esta variante genética sobre la salud intestinal, es necesario ampliar el conocimiento sobre cómo se ve afectada la colonización de otras bacterias y particularmente de las que componen la microbiota saludable del intestino.
Como conclusión, la selección genética proporciona una herramienta potente para mejorar y mantener la salud intestinal en la producción porcina industrial y, en el futuro, puede convertirse en una alternativa más sostenible a la importante necesidad de antibióticos que tenemos actualmente.
