Actualización sobre Clostridium difficile en porcino
21-jun-2016 (hace 8 años 9 meses 12 días)
Clostridium difficile es una bacteria Gram positiva, anaeróbica y formadora de esporas. La patología entérica producida por C. difficile afecta a varias especies incluyendo humanos, cerdos, caballos, primates no humanos, conejos, ratas, perros y gatos (Arroyo et al., 2005; Debast et al., 2009; Hopman et al., 2011; Keessen et al., 2011a; Norman et al., 2009).
En porcino, la infección causada por C. difficile (ICD) es una de las patologías entéricas más importantes del neonato y se observa principalmente en lechones de 1-7 días (Hopman et al., 2011; Songer and Anderson, 2006). Los signos clínicos incluyen una diarrea amarillenta y acuosa y estreñimiento (Yeager 2007). La colonización intestinal por C. difficile se produce durante las primeras horas de vida y, en algunas granjas, casi el 100% de los lechones están colonizados a las 48 horas del parto (Hopman et al., 2011); sin embargo, la enfermedad clínica sólo se observa en circunstancias concretas. La transmisión es oro-fecal y, a menudo, las bacterias y esporas son endémicas en el ambiente de la granja, aunque se ha demostrado que sólo aproximadamente el 25% de las cerdas muestreadas estaban excretando activamente C. difficile durante la lactación (Norman et al., 2009). Otros estudios han demostrado que el aire y el entorno son las fuentes principales de C. difficile para los lechones neonatos (Hopman et al., 2011). Las esporas de C. difficile son muy resistentes a los agentes físicos y químicos utilizados para limpiar las granjas y a la mayoría de desinfectantes (Fawley et al., 2007) y pueden sobrevivir durante muchos meses en el entorno (Speight et al., 2011). La prevalencia de C. difficile en porcino cae dramáticamente con la edad y estudios en diversos países revelaron una prevalencia consistentemente baja en cerdos de matadero, que oscila entre el 0% y el 8% (Baker et al., 2010; Hoffer et al., 2010).
Arruda et al. (2013) demostraron recientemente que, pese a que la mayoría de casos de C. difficile se producen en la primera semana de vida, los lechones de 10 días son tan susceptibles como los neonatos cuando se exponen a cepas toxigénicas de C. difficile. Se han descrito muchos factores de virulencia asociados a la ICD incluyendo proteínas de superficie y exotoxinas, pese a que se considera que las exotoxinas A y B (TcdA y TcdB, respectivamente) son los principales factores de virulencia asociados a la aparición de la enfermedad (Davies et al., 2011). Algunas cepas de C. difficile también producen una toxina binaria ribosilante de ADP; sin embargo, todavía no se ha dilucidado su papel en la patogénesis de la enfermedad (Davies et al., 2011).
Las lesiones asociadas a la ICD se concentran básicamente en el intestino grueso. El edema de mesocolon (figura 1) es la lesión macroscópica clásica que se observa en los casos de ICD. Sin embargo esta lesión no es patognomónica; Yaeger et al demostraron que el edema de mesocolon en lechones no es un buen predictor de toxinas por C. difficile (Yaeger et al., 2007). El examen histopatológico de los animales afectados reveló una colitis ulcerativa fibrinopurulenta multifocal o localmente extensa (figura 2).
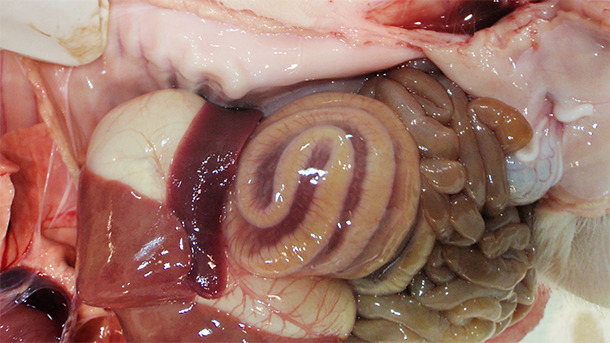
Figura 1. El edema de mesocolon es una lesión típica de los casos de ICD.
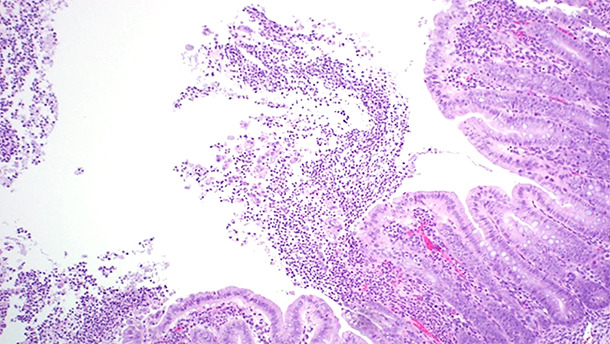
Figura 2. El examen histopatológico de los animales afectados reveló una colitis ulcerativa fibrinopurulenta multifocal o localmente extensa.
Se cree que hay muchos factores de riesgo que contribuyen a ICD, incluyendo: la administración de antibióticos, la dosis infectiva, el perfil de toxinas asociadas y la edad. En un estudio reciente, se demostró que la dosis infectiva está directamente correlacionada con la severidad de la enfermedad. Los hallazgos de este mismo estudio sugieren que el tratamiento antibiótico en el primer día de vida no tiene un papel importante en el desarrollo y/o severidad de las lesiones por ICD en lechones (Arruda, et al., 2013). Esto puede ser debido a que la falta de una microflora intestinal bien establecida en los lechones neonatos limita el impacto de los antibióticos sobre la misma (Arruda, et al., 2013). La tasa de mortalidad asociada a brotes de ICD es variable; sin embargo, se han descrito tasas tan altas como del 16% (Anderson and Songer, 2008). En los lechones recuperados se ha descrito retraso en el crecimiento y un menor peso al destete, unos 0,5 kg menos de media (Songer, 2004).
El diagnóstico de la ICD puede ser difícil debido a la naturaleza endémica de esta bacteria. Por ejemplo el simple aislamiento de la bacteria o la detección de la toxina (ELISA) no son suficientes para diagnosticar la enfermedad. Para un diagnóstico adecuado de ICD en lechones se recomienda un diagnóstico en múltiples fases incluyendo la identificación de casos potenciales (historia clínica), ELISAs para la detección de toxinas y examen histológico de secciones del intestino grueso.
Hasta el presente no hay ningún producto comercial autorizado para prevenir y/o tratar la ICD en lechones. Se ha demostrado que la dosis infectiva está directamente asociada a la severidad de la enfermedad, por lo que las prácticas que disminuyan la dosis de exposición de los lechones neonatos podría prevenir y/o minimizar la expresión de la enfermedad clínica. Finalmente, parece que el uso de C. difficile no-toxigénico (NTCD) como probiótico puede reducir la severidad de las lesiones histológicas y la cantidad de toxinas detectadas en los lechones neonatos (Arruda et al., 2016). En resumen, pese a la importancia de la ICD en lechones neonatos, siguen habiendo grandes lagunas en nuestro conocimiento de los conceptos básicos de la epidemiología, patogénesis y prevención en porcino.
