Biofilms: un peligro a controlar en plantas de procesamiento de alimentos
29-feb-2016 (hace 9 años 1 meses 26 días)
¿Qué son los BIOFILMS?
Un biofilm (o biopelícula) se puede definir como una comunidad microbiana sésil constituida por células que están adheridas a un sustrato sólido, inmersas en una matriz viscosa de sustancias poliméricas excretadas por las propias células (Figura 1).
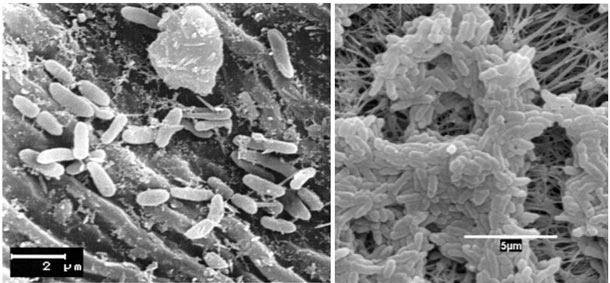
Figura 1. Células de Pseudomonas
(a) adheridas mediante fimbrias y exomucopolisacáridos en la superficie de una cuchilla (C. Moragrega) y
(b) recubriendo un filtro (L. Agustí). Fuente: INTEA-UdG.
El proceso de formación de un biofilm incluye diferentes etapas que se pueden resumir en: (1) formación espontánea de una fina capa de materia orgánica sobre una superficie inicialmente limpia, que conlleva una modificación de las propiedades del sustrato y altera el grado de adhesión bacteriana a la superficie; (2) colonización por bacterias, que son capaces de adherirse a la superficie mediante estructuras como pedúnculos o filamentos (pilis, fimbrias), y proteínas o polisacáridos extracelulares; (3) atrapamiento de partículas orgánicas e inorgánicas y de productos del metabolismo de las células que han iniciado la colonización, que también quedan retenidos en la matriz; (4) crecimiento de los microorganismos adheridos e incorporación de otros microorganismos, que contribuyen a incrementar el grosor del biofilm; (5) desprendimiento de porciones del biofilm, que pueden ser arrastradas hasta otras partes del sistema e iniciar una nueva colonización.
Un biofilm maduro puede contener del orden de 1016 células/m3 y una gran diversidad de especies microbianas. Dentro de la matriz de polisacáridos extracelulares se pueden encontrar microambientes con condiciones favorables para el crecimiento de determinados grupos microbianos. En la biopelícula se establecen gradientes de pH, oxígeno disuelto, concentración y tipo de nutrientes, etc. que pueden favorecer a diferentes miembros de la comunidad microbiana. Por ejemplo, en un biofilm de espesor considerable, la limitación de oxígeno en las capas más cercanas al sustrato puede originar regiones anóxicas que permiten la actividad de especies anaeróbicas, como las bacterias sulfato reductoras, que tienen un papel relevante en el desarrollo de procesos de corrosión de superficies metálicas.
Los microorganismos que forman estas comunidades presentan una fisiología y una pauta de crecimiento significativamente diferentes a las de los mismos microorganismos cuando se encuentran en suspensión (planctónicos); el biofilm facilita el establecimiento de relaciones entre ellos y se incrementa tanto la actividad metabólica como la tasa de división. Además, los biofilms constituyen un sistema de crecimiento que les proporciona protección y les permite sobrevivir en ambientes hostiles y se ha observado que presentan mayor resistencia a los agentes antimicrobianos y frente a los diversos factores de estrés.
Biofilms en la INDUSTRIA ALIMENTARIA
La adhesión de microorganismos en superficies y la consecuente aparición de recubrimientos microbianos ha sido documentada en muchos ambientes diferentes, entre ellos diferentes tipos de superficies de la industria alimentaria. Los biofilms además de afectar determinadas instalaciones, pueden ser fuente de contaminaciones, tanto de microorganismos deteriorantes como de microorganismos patógenos.
En la industria, los biofilms se forman a menudo en las superficies internas de sistemas de conducción de líquidos de equipamientos industriales (intercambiadores de calor, sistemas de transporte, sistemas de inyección, calderas, bombas, válvulas, membranas, sensores, etc.) provocando efectos negativos que pueden alterar la eficiencia, el rendimiento y el consumo energético de determinados procesos, favorecer fenómenos de corrosión que reducen la longevidad de la planta o incrementan los costes de mantenimiento y de reparación de daños estructurales.
Pero se pueden formar también sobre sistemas abiertos, como son paredes, techos y desagües de las salas de procesamiento, o superficies que contactan directamente con los alimentos, como mesas de trabajo, cintas transportadoras, determinadas partes del equipamiento, utensilios, etc.; e incluso directamente sobre los alimentos.
Estudios realizados durante los últimos años han demostrado que muchas bacterias, incluyendo algunos de los que más frecuentemente causan el deterioro de la carne, como Pseudomonas, Bochrotrix thermosphacta y Lactobacillus spp., así como patógenos como Salmonella spp., Listeria monocytogenes, Escherichia coli y Campylobacter jejuni crecen preferentemente en forma de biofilms adheridos a superficies. Incluso los materiales que consideramos lisos y resistentes a la contaminación se han mostrado, en análisis de laboratorio, susceptibles al desarrollo de biofilms. Por ejemplo, L. monocytogenes o Pseudomonas son capaces de adherirse a superficies de acero inoxidable con una rugosidad superficial muy baja pero suficiente para dificultar su eliminación (Figura 2).
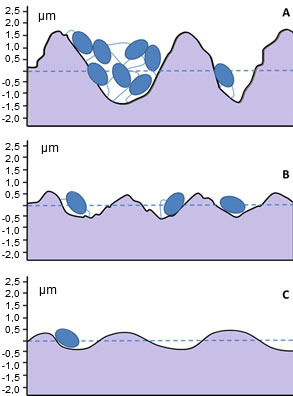
Figura 2. Comparación del tamaño de una célula de Pseudomonas con la rugosidad superficial de diferentes acabados de acero inoxidable que se utilizan en las industrias alimentarias:
(a) 180 grit, 32 RA: acabado típico de conducciones de transporte de agua purificada;
(b) 320 grit, 12 RA: acabado típico de sistemas de inyección de agua; y
(c) superficie b después de un electropulido. (Adaptado de: Edstrom Industries, Inc.)
¿Cómo se puede prevenir la formación de BIOFILMS?
Los biofilms, una vez implantados, son difíciles de erradicar, por lo tanto es mucho más eficaz prevenir su formación mediante un plan de limpieza y desinfección (L+D) adecuado que intentar eliminarlos de una zona donde ya se han formado.
Hay que tener presente que para garantizar la eficiencia de un plan L+D es imprescindible que el diseño de los equipos de procesamiento haya contemplado unos requerimientos higiénicos muy exigentes. Hay que evitar al máximo zonas de difícil acceso a los productos utilizados en las operaciones de L+D; las esquinas, surcos, juntas, etc., son zonas que propician la acumulación de biofilms. También es importante conocer la naturaleza tanto de la suciedad como de los microorganismos que pretendemos eliminar de las superficies. En función de todos estos factores se debe diseñar un plan que incluya los productos más adecuados, la concentración, la frecuencia y las condiciones de aplicación. Los sistemas de limpieza y desinfección mal diseñados pueden contribuir no sólo a un control ineficiente sino incluso al incremento de la resistencia de los biofilms.
Los productos de limpieza actúan como solubilizantes, dispersantes y/o desincrustantes de materia orgánica e inorgánica y evitan la acumulación de depósitos sobre las superficies, reduciendo la probabilidad de colonización microbiana; sin embargo, en las rutinas de higienización hay que incluir también agentes antimicrobianos que actúen específicamente sobre los microorganismos que podrían originar el biofilm. A menudo los desinfectantes utilizados son productos químicos (cloruros, bromuros, ozono, sales de amonio cuaternario, glutaraldehído, etc.) pero desde hace relativamente poco tiempo se han propuesto también nuevas estrategias de control de biofilms basadas en soluciones biológicas (enzimas, fagos, interacciones entre especies y moléculas antimicrobianas de origen biológico).
En este sentido, en el año 2014 se publicaron en la revista Meat Science dos artículos muy interesantes relacionados con este tema: una revisión de las causas, implicaciones, interacciones bacterianas y nuevas alternativas de control de biofilms en plantas de procesamiento de carne (Giaouris, E., et al, 2014) y un estudio que plantea la posibilidad de utilizar los mismos biofilms, formados por microbiota tecnológica segura, como sistema de control del crecimiento de microorganismos indeseables; concretamente, biofilms de Lactobacillus sakei de origen cárnico con efecto anti-Listeria (Pérez Ibarreche, M., et al, 2014).
