Mycoplasma hyorhinis: más que un comensal
27-jun-2013 (hace 11 años 9 meses 4 días)
La poliserositis y la artritis son problemas importantes que afectan a los cerdos tras el destete. Haemophilus parasuis y Streptococcus suis se consideran generalmente como su principal causa. Sin embargo, en los últimos años, se ha observado como Mycoplasma hyorhinis también juega un papel en los casos de artritis y poliserositis, aumentando la morbilidad y la mortalidad. Esta bacteria se encuentra comúnmente en explotaciones porcinas adherida al tracto respiratorio superior de los cerdos. Los lechones se infectan a través de las cerdas o de cerdos de más edad. A pesar de tratarse de una bacteria comensal, M. hyorhinis puede causar enfermedad sistémica grave a través de mecanismos que no se conocen del todo. Se cree que las diferencias entre las cepas, las infecciones concomitantes y determinadas condiciones ambientales estimulan el desarrollo de la enfermedad.

Figura 1. La presencia de cojeras tras el destete es un signo clínico frecuente observado en casos de enfermedad sistémica por M. hyorhinis.
Los signos clínicos incluyen fiebre, disnea, cojera y la reticencia a moverse en cerdos de 3 a 15 semanas de edad (Figura 1). Estos signos clínicos y las lesiones se han podido reproducir ampliamente mediante inoculaciones experimentales. Las lesiones agudas se caracterizan por la presencia de pleuritis, pericarditis fibrinosa y peritonitis (Figura 2). Las lesiones crónicas se caracterizan por adherencias pleurales y pericárdicas. En cerdos de engorde, M. hyorhinis es responsable principalmente de artritis que afecta comúnmente las patas traseras. Las articulaciones pueden contener grandes cantidades de líquido y fibrina, con la membrana sinovial engrosada y enrojecida. Las lesiones macroscópicas y aquellas observadas por histopatología son idénticas a las producidas por H. parasuis (enfermedad de Glässer), por lo que se hace necesario realizar una PCR o el aislamiento bacteriano para diagnosticar correctamente la etiología de la enfermedad y determinar el tratamiento antibiótico apropiado para la explotación afectada.
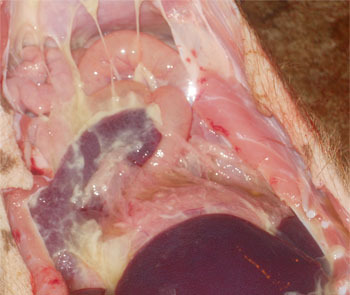
Figura 2. Poliserositis observada en enfermedad sistémica por M. hyorhinis.
Aproximadamente el 55% y el 12% de los casos de artritis y poliserositis, respectivamente, recibidos por el Laboratorio de Diagnóstico Veterinario de la Universidad de Minnesota (UMN-VDL) durante el año 2010 resultaron PCR-positivos para M. hyorhinis. Estos datos muestran el impacto de M. hyorhinis en la morbilidad y la mortalidad post-destete. El papel de M. hyorhinis como una causa de neumonía no es bien conocido, sin embargo, varios estudios han aislado o detectado M. hyorhinis con mayor frecuencia de pulmones con neumonía en comparación con pulmones normales. Algunas inoculaciones experimentales de cerdos gnotobióticos en combinación con técnicas de inducción de estrés han dado lugar a lesiones leves de neumonía. Aproximadamente, el 45% de los pulmones con neumonía recibidos por la UMN-VDL dieron positivo para M. hyorhinis por PCR, si bien parece que M. hyorhinis juega un papel secundario en los casos de neumonía.
¿Cómo diagnosticar M. hyorhinis?
La detección de M. hyorhinis es relativamente simple y dependerá del objetivo de la prueba. Si el objetivo es determinar la dinámica de colonización de M. hyorhinis en la granja, sería apropiado realizar muestreos seriados de fluidos orales, hisopos nasales u orofaríngeos de cerdos desde el destete hasta final de engorde (Figura 3-4). El número de muestras y la frecuencia de la recogida determinará la sensibilidad del protocolo. Es importante recordar que la detección de M. hyorhinis en alguna de las muestras no es indicativo de presencia de enfermedad ya que debemos recordar que se trata de una bacteria comensal del tracto respiratorio superior del cerdo. Determinar la dinámica de la colonización es un paso esencial para decidir el momento ideal de la aplicación de antibióticos o la vacunación.
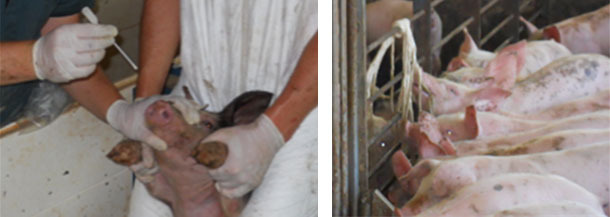
| Figura 3. Toma de hisopos nasales de lechones en transición para la detección de M. hyorhinis | Figura 4. Toma de muestras de fluidos orales de lechones en transición para la detección de M. hyorhinis |
Por otro lado, si el objetivo es determinar si M. hyorhinis es el causante de la poliserositis o la artritis, se deben tomar muestras de tejido o hisopos de lesiones a nivel pleural, pericárdico o peritoneal, donde la presencia del agente no se considera normal. En casos de artritis deben tomarse muestras de tejido articular o líquido sinovial. Las muestras deben ser tomadas de cerdos en fase aguda, que no hayan sido sometidos a tratamiento con antibióticos. Todas las muestras deben ser refrigeradas y enviadas rápidamente al laboratorio de diagnóstico para su análisis.
El aislamiento de M. hyorhinis en caldo Hayflick modificado y medios sólidos se puede lograr en un corto período de tiempo. Las colonias pueden observarse en medios sólidos alrededor de 4 a 15 días después de la inoculación. De momento no hay ensayos inmunológicos disponibles comercialmente para M. hyorhinis. Se han publicado varios protocolos de PCR para el ADN de M. hyorhinis, sin embargo, no son capaces de cuantificar la cantidad de ADN bacteriano en una muestra y se han desarrollado principalmente para la detección de M. hyorhinis en cultivos celulares, ya que esta bacteria es un contaminante común de cultivos celulares.
Tratamiento y control
M. hyorhinis es susceptible a la lincomicina, clindamicina, furaltadona, kanamicina y todas las sulfonamidas. Dado que los micoplasmas carecen de pared celular, las penicilinas y las cefalosporinas no tienen efecto sobre este patógeno. La administración de la medicación antes de la exposición o poco después puede aumentar el éxito del tratamiento con antibióticos. La información relativa a la eficacia de los antibióticos en condiciones de campo no está disponible. Actualmente no hay vacunas disponibles comercialmente. Algunos veterinarios han informado del uso de vacunas autógenas, sin embargo, no se ha evaluado su eficacia. La prevención de infecciones concomitantes (virus de la influenza y virus del PRRS) podría ayudar a reducir la propagación sistémica de M. hyorhinis.
