Pruebas diagnósticas para neumonía enzoótica (Mycoplasma hyopneumoniae)
12-ene-2010 (hace 15 años 3 meses 13 días)
Existen varias pruebas de laboratorio que se pueden utilizar para el diagnóstico de la neumonía enzoótica (EP). La elección de la prueba y el método de investigación dependen de las circunstancias clínicas y de la justificación para realizar las pruebas.
En términos generales, las herramientas de diagnóstico disponibles se clasifican en las siguientes categorías:
|
1. Detección del agente • Métodos basados en pruebas moleculares (PCR) para detectar el ADN del M. hyopneumoniae en tejido pulmonar, frotis nasales o lavados bronquiales. • Inmunohistoquímica (IHC) para demostrar la presencia de antígeno M. hyopneumoniae en secciones histológicas de lesiones pulmonares. • Hibridación in situ (ISH) para demostrar el ADN de M. hyopneumoniae en secciones histológicas de tejido pulmonar. • Cultivo para detectar M. hyopneumoniae a partir de tejido pulmonar o de otras muestras del aparato respiratorio. 2. Detección de anticuerpos • Pruebas serológicas para determinar la cantidad de anticuerpo circulante para M. hyopneumoniae. |
||
A pesar de que existe toda una gama de métodos diagnósticos descritos, la disponibilidad de estas pruebas varía de unos países a otros dependiendo del nivel de tecnología existente, del objetivo de determinados laboratorios y de los intereses de los veterinarios y los científicos de laboratorio que trabajan en ello.
Las políticas sobre pruebas de garantía sanitaria en el ámbito industrial y los métodos recomendados por los principales veterinarios porcinos también pueden influir en la disponibilidad de las pruebas diagnósticas ofrecidas por los laboratorios.
Escenarios de diagnóstico
|
1) Sospecha de brotes agudos de EP en una granja anteriormente negativa. En este caso, el factor clave es la confirmación de si M. Hyopneumoniae ha sido o no el causante del fallo en la granja. Esto se puede comprobar enviando los cerdos muertos o cerdos vivos afectados al laboratorio de diagnóstico para su examen post-mortem. El tejido pulmonar fresco se puede examinar por PCR y conservarse muestras pulmonares para una posterior confirmación, si fuera necesario, mediante pruebas de IHC o ISH. |
||
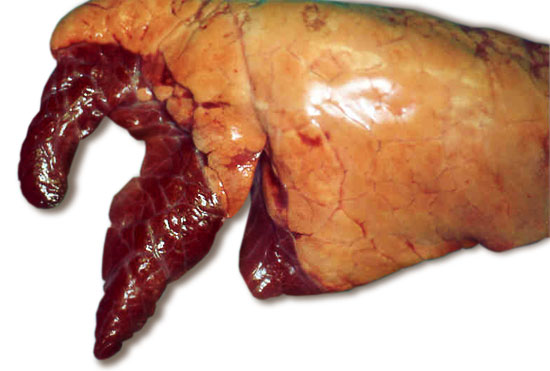
Fig 1. Aspecto típico de pulmones con neumonía enzoótica. Los lóbulos pulmonares antero-ventrales oscurecidos se encuentran consolidados por la infección.
|
Además del examen post-mortem, se pueden recoger muestras de cerdos vivos afectados para pruebas de PCR. Según mi experiencia, los frotis de garganta obtenidos correctamente, proporcionan una tasa de sensibilidad diagnóstica más elevada que los frotis nasales y el uso de una técnica de PCR “anidada” optimiza la sensibilidad de la prueba, lo que la convierte en una herramienta de diagnóstico sumamente valiosa. Agrupando los frotis en lotes de 5 frotis por grupo se consigue un número representativo de cerdos a examinar de modo rentable. El primer conjunto de muestras de sangre para serología pareada se puede recoger en este estadio agudo; en el caso ideal, los cerdos de los que se han obtenido muestras deberían etiquetarse para que pudieran compararse correctamente las muestras de suero de cerdos convalecientes obtenidas 3-4 semanas más tarde con las muestras del estadio agudo considerando cerdos individuales. 2) Diagnóstico de M. hyopneumoniae como parte del “complejo respiratorio porcino” (CRP) En situaciones de neumonía compleja, en la que pueden estar implicadas una o más infecciones concomitantes, se aconseja ampliar la investigación y el protocolo de muestreo de modo que se incluya material para otras pruebas. Esto incluye tejido pulmonar fresco para bacteriología y virología y/o pruebas de PCR para otros agentes. La histopatología en 3 áreas representativas del tejido pulmonar proporciona una mejor comprensión de la naturaleza de las lesiones neumónicas. En casos crónicos de infección por M. hyopneumoniae existen ciertas características que se pueden describir como altamente sugerentes del diagnóstico, pero las lesiones no son verdaderamente específicas, por lo que debe comunicarse con precaución. |
||
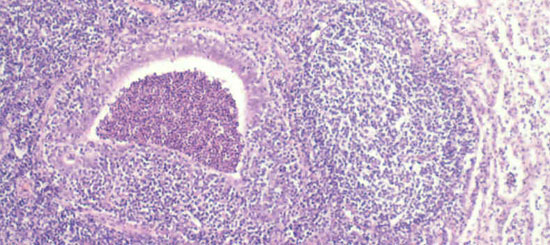
Fig 2. Las reacciones inflamatorias crónicas en las vías respiratorias y a su alrededor son rasgos típicos de la neumonía enzoótica crónica.
|
Se pueden emplear tejidos histopatológicos incluidos en parafina para IHC o ISH para demostrar la presencia de agentes asociados a las lesiones. Debe ponerse atención en incluir vías aéreas ciliadas en los tejidos seleccionados para demostrar la presencia de M. hyopneumoniae más eficazmente. Cuando el CRP sea un problema crónico en la granja, se pueden realizar pruebas serológicas de muestras únicas para detectar la presencia de M. hyopneumoniae y de otros agentes. 3) Cribado de cerdos sanos para comprobar que están exentos de M. hyopneumoniae como parte de un programa de garantía sanitaria. Además de la inspección clínica de las granjas y de las comprobaciones realizadas en los pulmones de cerdos sacrificados, se puede hacer un cribado para M. hyopneumoniae en un número representativo de cerdos en edades de alto riesgo (esto es, engorde o cebo) mediante frotis de garganta, así como con la toma de muestras de sangre para serología. Es arriesgado fiarse sólo de la serología porque puede haber una fase de retraso de hasta 4-6 semanas antes de que haya números apreciables de cerdos que tengan anticuerpos circulantes mensurables después de la infección. Las pruebas de PCR tienen un alto grado de especificidad y permiten una detección más precoz de la infección. Las pruebas de PCR también se pueden usar eficazmente en granjas exentas de EP que hayan sido vacunadas como un seguro frente a la posibilidad de enfermedad grave, en el caso de que se produzca una crisis en una granja no infectada anteriormente. Exactitud de las pruebas Deben tenerse en cuenta los factores relativos a la especificidad y la sensibilidad de las pruebas cuando se interpreten los resultados del laboratorio. La especificidad de las pruebas ELISA, tanto la indirecta como la de bloqueo, para M. hyopneumoniae es buena, pero no al 100%. Se sabe que se producen resultados falsos positivos, pero esto se puede mantener en un nivel mínimo si los laboratorios disponen de buenos procedimientos internos de control de calidad y repiten las pruebas de las muestras que dan títulos positivos bajos para comprobar la validez de los resultados. Asimismo, los laboratorios que realizan las pruebas de PCR deben tener protocolos rigurosos para minimizar el riesgo de contaminación cruzada y de resultados falsos positivos, más especialmente cuando se utilicen métodos de PCR “anidados” Se precisan controles internos de PCR para evitar resultados falsos negativos. Las pruebas de IHC y de ISH son técnicas especializadas de histopatología y la interpretación de las secciones es competencia exclusiva de patólogos veterinarios expertos. La fluorescencia o la tinción no específicas pueden confundirse con la fluorescencia o el marcado de agentes para el diagnóstico, a no ser que los patólogos tengan experiencia en este campo y se empleen controles adecuados. Aunque en la lista de métodos de detección se incluyó el cultivo de M. hyopneumoniae, no es práctico en el uso diagnóstico de rutina, debido a que tiene una tasa de crecimiento muy lenta, a que se necesitan medios especializados y a la frecuencia con que M. hyopneumoniae es superado en crecimiento por organismos comensales, habitualmente M. hyorhinis. Este gasto y la baja sensibilidad del cultivo de M. hyopneumoniae lo hace poco práctico a menos que se requieran aislados específicamente para realizar pruebas de sensibilidad antimicrobiana. |
||
