Epidemiología y transmisión de PCV2 y de la circovirosis porcina
18-dic-2007 (hace 17 años 3 meses 15 días)
PCV2 es un virus ubicuo en cerdos y jabalíes. No obstante, ello no se correlaciona necesariamente con la distribución de la circovirosis porcina a nivel mundial. Es cierto que la enfermedad ha sido descrita en todos los continentes, pero aún existen países en los cuales la infección está presente, pero donde el proceso clínico no ha sido aún descrito (¿falta de métodos diagnósticos o ausencia real de la enfermedad?). Esta temática volvería a tener una conexión con la existencia de distintos genotipos de PCV2 con una aparentemente distinta patogenicidad. ¿Podría ser que algunos países presentaran cerdos infectados con un genotipo poco patogénico en comparación con otros? Un estudio Danés publicado muy recientemente sugiere la existencia de un tercer genotipo de PCV2 (genotipo 3) que se detectó en muestras de cerdo correspondientes a los años 1980, 1987 y 1990. La existencia de este tercer genotipo podría indicar que se produciría un “gradiente genotípico” desde los años 80 hasta la actualidad que seguiría el orden de genotipos 3, 2 y 1, siendo este último el aparentemente relacionado con los brotes epizoóticos de enfermedad que se dieron en Dinamarca. Actualmente desconocemos si ello es extrapolable al resto de Europa y si este “gradiente genotípico” también se ha dado o no en otras regiones del mundo.
Desde el punto de vista de las especies susceptibles a la infección por PCV2, al margen del cerdo doméstico y del jabalí, se desconoce la existencia de otras que pudieran serlo. Al menos no se ha descrito infección por PCV1 o PCV2 en ninguna de las especies estudiadas: perro, gato, oveja, cabra, caballo, bovino, conejo, rata, ratón, pollo y especie humana (incluidas personas con un teórico alto riesgo de infección como podrían ser los veterinarios).
La dinámica de infección por PCV2 en granjas con y sin circovirosis porcina se ha estudiado a través de sero-perfiles y también de lo que llamamos PCR-perfiles (detección del genoma del agente mediante PCR en muestras estratificadas según edad, igual que los sero-perfiles). Actualmente también podríamos hablar de perfiles de carga vírica (fig. 1), basados en la utilización de PCR cuantitativa.
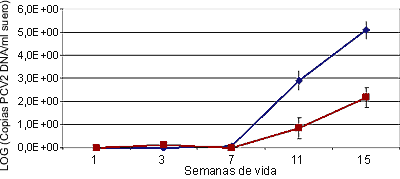
Figura 1. El uso de la PCR cuantitativa para la detección de PCV2 permite establecer la carga vírica en los animales estudiados. Los animales afectados de circovirosis porcina (línea azul) presentan una carga vírica en suero significativamente mayor que los animales sanos (línea rosa).
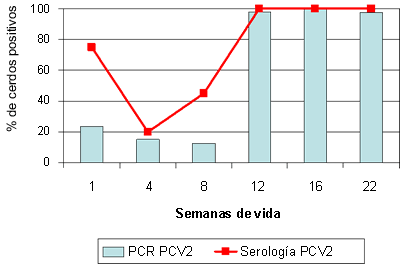
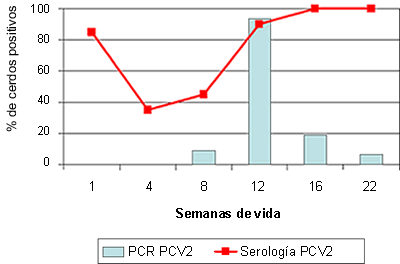
La dinámica de anticuerpos frente a PCV2 es relativamente homogénea y predictible en la mayoría de granjas (Fig. 2). La inmunidad humoral maternal tendría una duración variable entre 4 y 12 semanas de vida, observándose sero-conversión a partir de las 8-16 semanas de vida. En contraposición, la dinámica de detección de PCV2 (mediante técnicas de PCR) puede ser relativamente errática, con infección en cerdos muy jóvenes (incluso en paridera, Fig. 2A) y detección del virus en prácticamente todos los grupos de edad, o bien pico de infección en un grupo de edad y detección de PCV2 de forma esporádica en otros grupos de animales (Fig. 2B). Entre estos dos extremos se puede encontrar prácticamente cualquier situación intermedia. Eso si, en general, no se encuentra un elevado porcentaje de cerdos infectados con PCV2 en las primeras edades, y en cambio este pico se suele encontrar entre las 6 y 14 semanas de vida. En este contexto hay que destacar que los lechones procedentes de cerdas que presentan un bajo título de anticuerpos frente a PCV2 o bien un resultado positivo a la detección del virus (por PCR) alrededor del parto, presentan un mayor riesgo de sufrir circovirosis porcina.
|
A |
 |
| B |
 |
|
Figura 2. Sero- y PCR-perfiles frente a PCV2 de dos granjas afectadas de circovirosis porcina entre las semanas 9 y 14 de vida (recuadros con línea discontinua).
A: Granja en la que se observa un cierto porcentaje de lechones de primera semana de vida con infección (medida por PCR estándar) así como elevados porcentajes de cerdos infectados en distintas edades. B: Granja en que existe un pico de infección con PCV2 alrededor del momento de aparición de la enfermedad. |
|
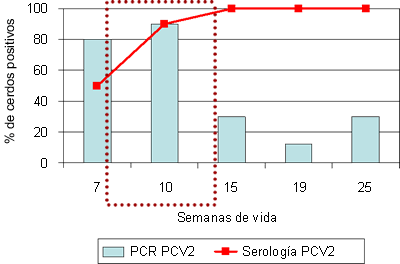
Cabe destacar, no obstante, que la dinámica de infección por PCV2 puede ser muy similar en granjas con y sin enfermedad (Fig. 3), lo que refuerza el carácter multifactorial de la misma, y que las técnicas serológicas e incluso de detección de PCV2 no son suficientes como para diagnosticar la enfermedad.
|
A |
 |
| B |
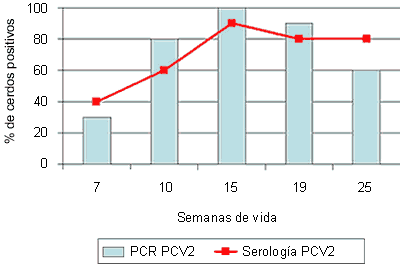 |
|
Figura 3. Sero- y PCR-perfiles (desde la semana 7 de vida) frente a PCV2 de una granja afectada por circovirosis porcina entre las 8 y 14 semanas de vida (recuadro con línea discontinua) (A), y otra aparentemente normal, sin síntomas compatibles con la enfermedad (B).
|
|
Por otro lado, se ha detectado PCV2 (por PCR) en suero de cerdos al menos hasta 28 semanas de vida, y en algunos casos esta positividad (desconociendo si es contínua o intermitente) ha durado al menos hasta 21 semanas. Es por ello que se cree que, en un cierto porcentaje de animales, el PCV2 puede establecer una infección persistente en los cerdos.
El virus se ha podido detectar en distintas vías potenciales de excreción, incluyendo secreciones nasales, saliva, tonsila, moco traqueal, orina, heces, semen y secreciones oculares, lo que indicaría que PCV2 podría excretarse potencialmente por cualquier vía orgánica. Es más, los animales que padecen una circovirosis porcina, además de presentar una carga vírica significativamente superior en suero, también excretan significativamente más cantidad de virus.
Se asume que la ruta de transmisión de PCV2 más probable sea la vía oro-nasal, lo que indicaría que la transmisión horizontal (cerda-lechón o lechón-lechón) son eventos frecuentes o muy frecuentes. Si entre los 2 y 4 meses de vida se infectan prácticamente todos los animales en una granja, PCV2 tiene que ser un virus altamente contagioso. No obstante, quizás el dato de interés más reciente sea la demostración de que no solamente PCV2 es transmisible, sino que también se puede transmitir la circovirosis porcina de un cerdo enfermo a uno sano. A pesar de que ello pueda suponer una obviedad a la vista de la mayoría de lectores, no lo era desde el punto de vista científico. También es cierto que en algunos de los modelos de transmisión documentados, casi siempre existe la co-infección con algún otro patógeno, cosa que no debería sorprender ya que… ¡es lo que suele ocurrir en condiciones de campo! Por otro lado, se sabe que PCV2 se puede detectar en el semen, pero si ello es suficiente como para causar una infección intrauterina con consecuencias patológicas (muerte embrionaria, muerte fetal o bien subsiguiente desarrollo de circovirosis porcina por parte de los fetos infectados), se desconoce en la actualidad.
