Consideraciones adicionales sobre los aminoácidos: digestibilidad in-vitro y los otros aa no esenciales
Escribe S. López s.lopez@unileon.es
05-feb-2007 (hace 18 años 2 meses 14 días)Introducción
Los sistemas actuales de valoración proteica de los alimentos para el ganado porcino se basan en la determinación del contenido en aminoácidos (especialmente de los que son esenciales) y en la estimación de la eficiencia con que dichos aminoácidos son utilizados a nivel digestivo (cuánto de lo ingerido es absorbido) y metabólico (cuánto de los absorbido es utilizado para la síntesis de proteínas). La digestibilidad de los aminoácidos es un elemento clave en la valoración proteica. La determinación de la digestibilidad in vivo es costosa y laboriosa, y requiere disponer de animales provistos de cánulas en alguna parte del tubo digestivo (fundamentalmente en la parte terminal del ileon). Por este motivo, se han diseñado técnicas in vitro para estimar la digestibilidad de los aminoácidos en el ganado porcino.
Fundamento
El objetivo de estas técnicas es simular en el laboratorio los procesos de digestión de las proteínas que tienen lugar en el estómago e intestino delgado del cerdo. Con este fin, el alimento es sometido a la acción de enzimas proteolíticas con una actividad y especificidad similares a las de las enzimas digestivas, en condiciones controladas para lograr la máxima digestión posible de las proteínas del alimento.
Metodología
Las técnicas in vitro de digestibilidad consisten, básicamente, en dos procesos secuenciales:
Ventajas e inconvenientes de las técnicas in vitro
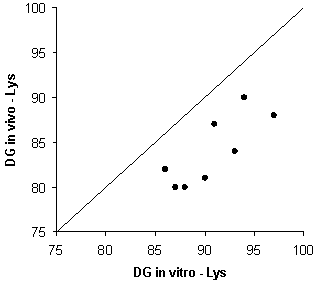
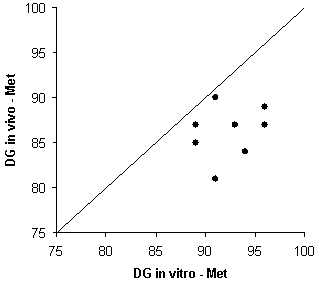
Las técnicas de digestibilidad in vitro son mucho más sencillas, rápidas y baratas que los métodos in vivo. Las condiciones experimentales están más controladas, por lo que están sujetas a un menor número de factores de variación (los resultados son más repetibles y reproducibles). No obstante, es necesario estandarizar las técnicas con el fin de que los coeficientes de digestibilidad publicados puedan ser más fácilmente interpretables, comparables y extrapolables. La digestibilidad in vitro es una digestibilidad real, ya que no hay interferencia por la presencia de aminoácidos de origen endógeno en la digesta, tal y como ocurre cuando se utilizan métodos in vivo. Las técnicas in vitro permiten estimar coeficientes de digestibilidad de los aminoácidos con un aceptable nivel de precisión (tabla 1). Los valores de digestibilidad in vitro e in vivo están significativamente correlacionados, aunque puede apreciarse diferencias de magnitud variable entre ambos (figura 1); entre otras razones porque el método in vitro es un modelo simplificado en el que las condiciones in vivo no pueden ser reproducidas o simuladas completamente. A pesar de sus inconvenientes, los coeficientes de digestibilidad determinados mediante métodos in vivo deben ser considerados como los valores de referencia.
Tabla 1.- Coeficientes de digestibilidad in vitro e in vivo de la proteína y de los aminoácidos para la cebada y la soja.
Figura 1.- Relación entre la digestibilidad in vitro y la digestibilidad in vivo de la lisina y de la metionina
Los sistemas actuales de valoración proteica de los alimentos para el ganado porcino se basan en la determinación del contenido en aminoácidos (especialmente de los que son esenciales) y en la estimación de la eficiencia con que dichos aminoácidos son utilizados a nivel digestivo (cuánto de lo ingerido es absorbido) y metabólico (cuánto de los absorbido es utilizado para la síntesis de proteínas). La digestibilidad de los aminoácidos es un elemento clave en la valoración proteica. La determinación de la digestibilidad in vivo es costosa y laboriosa, y requiere disponer de animales provistos de cánulas en alguna parte del tubo digestivo (fundamentalmente en la parte terminal del ileon). Por este motivo, se han diseñado técnicas in vitro para estimar la digestibilidad de los aminoácidos en el ganado porcino.
Fundamento
El objetivo de estas técnicas es simular en el laboratorio los procesos de digestión de las proteínas que tienen lugar en el estómago e intestino delgado del cerdo. Con este fin, el alimento es sometido a la acción de enzimas proteolíticas con una actividad y especificidad similares a las de las enzimas digestivas, en condiciones controladas para lograr la máxima digestión posible de las proteínas del alimento.
Metodología
Las técnicas in vitro de digestibilidad consisten, básicamente, en dos procesos secuenciales:
1)
Digestión enzimática de las proteínas Este proceso, a su vez, se puede llevar a cabo en una o varias etapas, siendo lo más habitual las técnicas con dos incubaciones sucesivas: |
||
1.a.
En primer lugar se simula la digestión gástrica incubando
el alimento en una disolución de HCl y pepsina, en un medio ácido
(pH en torno a 2). 1.b. A continuación se simula la digestión que tiene lugar en el duodeno. Para ello, se aumenta el pH hasta valores en torno a 8 (medio básico) mediante la adición de NaOH o de un buffer y se realiza una incubación en una disolución de pancreatina (extracto de jugo pancreático). |
||
Ambas
incubaciones se realizan a 38-40 ºC. Los tiempos de incubación
deben ser lo suficientemente largos para alcanzar la máxima digestión
posible, y se han sugerido tiempos de 6 h para la primera incubación
y de 24 h para la segunda. |
||
2.a.
Diálisis: Las incubaciones se realizan dentro de un sistema
de diálisis, de forma que, a medida que las proteínas se
hidrolizan, los compuestos de bajo peso molecular formados atraviesan
la membrana porosa de diálisis y son recogidos en una disolución
tamponada. Se asume que los aminoácidos solubles recuperados en
dicha disolución representan a aquellos que son digeridos y absorbidos
en el intestino. En este sistema se evita la posible inhibición
de la actividad enzimática por acumulación de productos
finales de la digestión. 2.b. Filtración o centrifugación: Las incubaciones se realizan en un sistema totalmente cerrado. Al final de la incubación se añade un reactivo (ácido tricloroacético o sulfosalicílico) que precipita los compuestos nitrogenados solubles que no han sido realmente digeridos. Posteriormente, se realiza una filtración o una centrifugación para separar la fracción no digerida (residuo retenido en el filtro o sedimento depositado por centrifugación) de la que es digerida (filtrado o sobrenadante). |
||
| Factores
que afectan a la determinación de la digestibilidad in vitro |
||
a)
Sustrato de incubación: tipo de alimento, cantidad de muestra incubada,
tamaño de partícula de la muestra (preparación de
la muestra). b) Enzimas utilizadas para la hidrólisis: tipos de extractos enzimáticos (fluidos digestivos o enzimas purificadas), concentración, especificidad y actividad (estabilidad, inhibidores, activadores) de las enzimas, relación enzima:sustrato. c) Condiciones de incubación: pH, temperatura, tiempo de incubación. d) Procedimiento de separación de la fracción digerida: método, tamaño de poro de la membrana de diálisis o del filtro |
||
Ventajas e inconvenientes de las técnicas in vitro
Las técnicas de digestibilidad in vitro son mucho más sencillas, rápidas y baratas que los métodos in vivo. Las condiciones experimentales están más controladas, por lo que están sujetas a un menor número de factores de variación (los resultados son más repetibles y reproducibles). No obstante, es necesario estandarizar las técnicas con el fin de que los coeficientes de digestibilidad publicados puedan ser más fácilmente interpretables, comparables y extrapolables. La digestibilidad in vitro es una digestibilidad real, ya que no hay interferencia por la presencia de aminoácidos de origen endógeno en la digesta, tal y como ocurre cuando se utilizan métodos in vivo. Las técnicas in vitro permiten estimar coeficientes de digestibilidad de los aminoácidos con un aceptable nivel de precisión (tabla 1). Los valores de digestibilidad in vitro e in vivo están significativamente correlacionados, aunque puede apreciarse diferencias de magnitud variable entre ambos (figura 1); entre otras razones porque el método in vitro es un modelo simplificado en el que las condiciones in vivo no pueden ser reproducidas o simuladas completamente. A pesar de sus inconvenientes, los coeficientes de digestibilidad determinados mediante métodos in vivo deben ser considerados como los valores de referencia.
Tabla 1.- Coeficientes de digestibilidad in vitro e in vivo de la proteína y de los aminoácidos para la cebada y la soja.
| Cebada | Soja | |||
| Digestibilidad in vitro | Digestibilidad in vivo (ileal) | Digestibilidad in vitro | Digestibilidad in vivo (ileal) | |
| Proteína | 87 | 78 | 93 | 84 |
| Lisina | 86 | 78 | 94 | 88 |
| Metionina | 89 | 84 | 96 | 89 |
| Treonina | 87 | 79 | 92 | 84 |
Figura 1.- Relación entre la digestibilidad in vitro y la digestibilidad in vivo de la lisina y de la metionina
  |
