La dilución y la conservación del semen
16-ene-2007 (hace 18 años 3 meses 1 días)
Existen varios métodos para asegurar la dilución y conservación de las dosis, si bien algunos principios básicos son comunes para todas las técnicas:
Escoger un diluyente
Debe utilizarse un diluyente de composición más o menos compleja pero con un buen poder tamponador para mantener las condiciones de pH y que proporcione los azúcares necesarios para la supervivencia de las células así como otros elementos más complejos que permitan asegurar una duración más o menos larga. Si bien la elección de un diluyente es muy importante, lo más importante es partir de un semen de buena calidad. Como ya hemos comentado existen varios diluyentes que pueden agruparse, en función de algunos principios de base, en varias categorías.
Composición de varios diluyentes porcinos (1) (Flowers, 2004)
| Ingredientes | BTS | Kiev | Modena | Zorlesco | Androhep |
| Sustrato energético | |||||
| Glucosa (anhidra), g/l | 37,00 | 66,00 | 27,50 | 11,70 | - |
| Glucosa (monohidrato), g/l | - | - | - | - | 26,00 |
| Sistema tampón | |||||
| Citrato sódico (2), g/l | 6,00 | 3,75 | 6,90 | 11,70 | 8,00 |
| Bicarbonato sódico, g/l | 1,25 | 1,25 | 1,00 | 1,80 | 1,20 |
| EDTA (disodio), g/l | 1,25 | 3,70 | 2,35 | 2,10 | 2,40 |
| Cloruro de potasio, g/l | 0,75 | - | - | - | - |
| Ácido cítrico, g/l | - | - | 2,90 | 3,80 | - |
| Tris buffer (base), g/l | - | - | 5,65 | 6,50 | - |
| HEPES, g/l | - | - | - | - | - |
| Estabilización de la membrana | |||||
| Cisteína, g/l | - | - | - | 0,10 | - |
| BSA (fracción V) | - | - | - | - | 2,50 |
| Antibióticos (3) | |||||
| Neomicina sulfato, g/l | - | - | - | 1,00 | - |
| Penicilina G (Na), g/l | 0,60 | 0,60 | 0,60 | - | 0,60 |
| Dihidrostreptomicina, g/l | 1,00 | 1,00 | 1,00 | - | 1,00 |
(1) las fórmulas de los diluyentes se han obtenido de informaciones originales publicadas en artículos.
(2) el EDTA, citrato sódico y otros agentes quelantes también ayudan a la estabilización de las membranas.
(3) el tipo y la cantidad de antibióticos agregados se ajustan a menudo según las situaciones individuales.
Diluyente base (o diluyente de referencia): fórmula BTS. Fórmula ideada por el Dr. Pursel en Estados Unidos, constituye una fórmula de base que, si bien actualmente ha quedado un poco antigua, nos permite explicar el papel de un diluyente a través de sus componentes:
- Glucosa: aporta la energía indispensable para la supervivencia del espermatozoide.
- Citrato de sodio, bicarbonato de sodio y cloruro de potasio: aporte mineral para garantizar el equilibrio físico-químico (pH, equilibrio iónico).
- EDTA: anticoagulante que permite evitar la aglutinación y la precipitación de los espermatozoides en el diluyente.
- Antimicrobiano: garantiza que no proliferen las bacterias durante la conservación.
Diluyentes para una conservación de corta duración. Del tipo de la fórmula BTS pero con variantes, se utilizan generalmente para conservaciones no superiores a 48-72 horas con semen refrigerado.
Diluyentes modernos para una conservación de larga duración. Son diluyentes complejos que permiten conservaciones de 5 a 6 días con ciertas exigencias particulares relacionadas con:
- La fracción a recoger: en general la fracción rica.
- Un tipo de dilución de 1/10 a 1/15 con agua destilada.
- Un control muy elevado de la contaminación bacteriana con un antimicrobiano no espermicida.
- Una refrigeración progresiva por etapas para alcanzar 15-17ºC con una variación mínima de temperatura.
El agua
El agua es un elemento esencial y escoger que tipo de agua vamos a utilizar es primordial. El agua es el soporte de dilución del diluyente y no debe perturbar los equilibrios físico-químicos ni aportar ninguna toxicidad. Son numerosos los accidentes relacionados con la calidad del agua como por ejemplo: agua mineral para consumo humano muy rica en calcio, agua desmineralizada para baterías de automóviles utilizando columnas en mal estado, agua procedente de un osmotizador mal regulado, agua mal conservada almacenada en bidones de plástico a la luz (algas...).
| • Ejemplo del bicarbonato: | |||
| Diluyente Agua mineral |
800 mg/l 200 a 400 mg/l |
||
| • Calcio: | |||
| Diluyente Agua mineral |
0 mg/l 50 a 500 mg/l |
||
| La presencia de calcio perturba la viabilidad de los espermatozoides y dificulta la conservación. | |||
Los diferentes sistemas son:
• Destilación: utiliza material pesado con un mantenimiento bastante difícil aunque el agua bidestilada sigue siendo la referencia.
•  Osmosis inversa: actualmente el material es más accesible pero reservado solo para CIA de más de 20 verracos. Este sistema de purificación química no garantiza la calidad bacteriológica y debe utilizarse junto a un sistema de ultrafiltración o de ultravioletas, en caso contrario, debe reforzarse la vigilancia bacteriológica.
Osmosis inversa: actualmente el material es más accesible pero reservado solo para CIA de más de 20 verracos. Este sistema de purificación química no garantiza la calidad bacteriológica y debe utilizarse junto a un sistema de ultrafiltración o de ultravioletas, en caso contrario, debe reforzarse la vigilancia bacteriológica.
• Desmineralización o desionización: si bien este proceso permite obtener agua para baterías de coches o para planchas, no está hecho para producir agua para la IA. El riesgo de toxicidad es muy importante, en particular con la desmineralización con resinas (residuos tóxicos). Este método por sí solo no es suficiente y debe utilizarse de forma conjunta con uno de los métodos anteriores.
Criterios a tener en cuenta
| Conductividad (microSiemens/cm) | 1 |
| pH | 5 a 5,7 |
| Recuento bacteriano (ufc/ml) | 0 a 10 |
| Presión osmótica (mosmoles) | 0 |
Preparación del diluyente
| 1. Poner los bidones de agua destilada o purificada para la IA al baño maría a 37° C durante 25 min. |
|
| 2. Verter el agua en un vaso de precipitados para mezclar el diluyente o verter directamente en la botella el contenido de la bolsita. |
|
|
3. Homogeneizar con la ayuda de: • un agitador magnético |
|
| 4. Esperar como mínimo 15 min. para una buena disolución y estabilización físico-química, verificar la temperatura. |  |
Respetar la tasa de dilución
Las fórmulas de los diluyentes sólo funcionan respetando una tasa de dilución mínima ya que el efecto tampon y el poder protector de la membrana sólo pueden ejercerse dentro de un cierto rango de dilución, generalmente entre 1/10 y 1/25. Este rango depende de los diluyentes y respetar la dilución es de mayor importancia cuanto mayor es el periodo de conservación que deseamos.
Limitando la recogida a 200-250 ml nos encontramos en el mejor rango para la mayoría de las concentraciones en espermatozoides, por contra, al recoger la totalidad del eyaculado podemos encontrarnos a menudo por debajo de la dilución mínima. En referencia al riesgo vinculado a un dilución máxima del orden de 1/25 a 1/30 corresponde al riesgo de fabricar más de 60 dosis a partir de un único eyaculado y esto a pesar de los controles efectuados.
| Respetar los principios de la dilución: 1/10 1/25 | ||
Dilución 1/10 |
Dilución 1/25  |
Dilución 1/4 |
| 200 ml de eyaculado y 60x109 espermatozoides: 1,8 l de diluyente, 20 dosis potenciales y 20 dosis producidas | 200 ml de eyaculado y 150x109 espermatozoides: 4,8 l de diluyente, 50 dosis potenciales y 50 dosis producidas | 500 ml de eyaculado y 60x109 espermatozoides: 1,5 l de diluyente, 20 dosis potenciales, 0 dosis producidas |
El shock térmico
El momento de la mezcla entre el semen y el diluyente es de especial sensibilidad:
Verter lentamente el semen dentro del diluyente tras haber verificado la temperaura.
El acondicionamiento de las dosis
Los acondicionamientos son tan numerosos como las empresas que trabajan dentro del dominio de la IA porcina:
| - Botellas flexibles 60 a 100 ml | |
 |
|
| - Tubos soldables de 80 a 100ml | |
| - Bolsas de 60 a 100ml (blisters …) | |
 |
|
| - Unidades de inseminación que integran dosis y catéteres. | |
Cada sistema presenta ventajas e inconvenientes pero para todos los casos hay 2 puntos a tener en cuenta:
- Los materiales deben estar limpios y no deben contaminar el semen (almacenaje en locales limpios y dentro de embalajes cerrados)
- El tipo de sistema escogido debe permitir limitar al máximo el contacto entre el aire y el semen (anaerobiosis)
Normas de conservación
Si bien la congelación es actualmente un método útil para conservar el semen, sus resultados, inferiores a los obtenidos mediante refrigeración, hacen de ella un método de conservación destinado principalmente a la conservación de semen de verracos particulares o para la exportación de semen.
El método de referencia continúa siendo la refrigeración a una temperatura alrededor de los 15-17°C con resultados excelentes en fertilidad (+90%) en comparación con otras especies (vacas, ovejas…).
1. Conservación de corto a medio plazo (24-72h): se trata del caso más frecuente incluso para los que trabajan con semen fresco (si la primera IA se realiza frecuentemente con dosis de menos de 24 h, la 2ª o la 3ª corresponden a menudo con una dosis de 48 à 72h)
- Refrigeración progresiva por etapas.
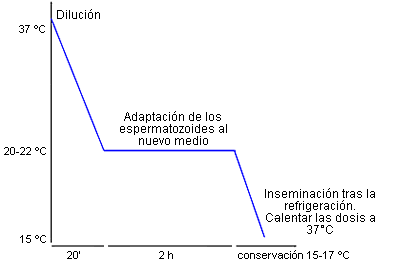
- Una temperatura de conservación estable entre 15 y 17°C.

2. Conservación a largo plazo (superior a 3 días y pudiendo llegar hasta los 7 días):
- Escoger los mejores verracos bien mediante el examen del semen o bien mediante pruebas específicas (examen de los acrosomas, resistencia osmótica…). Sólo el semen de algunos verracos tiene la capacidad de poderse conservar durante un periodo más largo de tiempo y es importante seleccionar estos verracos con otras pruebas diferentes a la de la motilidad ya que la capacidad fecundante del semen a menudo disminuye de forma más rápida que la motilidad (integridad del acrosoma…). Finalmente es necesario verificar la compatibilidad del diluyente y del verraco, a veces algunos diluyentes no son los convenientes para algunos verracos.
- Escoger un diluyente para larga conservación: es a este nivel que los componentes capaces de controlar los residuos metabólicos y de mantener la integridad de la membrana son muy útiles.
- Dejar un tiempo de adaptación del semen diluido a la temperatura ambiente (20-22°C) durante 2 a 3 horas antes de empezar la refrigeración..
- Girar de 1 a 2 veces al día las dosis para evitar los efectos nefastos de la sedimentación.
Control de la dilución y de la conservación
 1. Control rápido tras la dilución: el objetivo es detectar un eventual incidente durante la dilución (shock térmico, toxicidad …).
1. Control rápido tras la dilución: el objetivo es detectar un eventual incidente durante la dilución (shock térmico, toxicidad …).
2. Control a los 3 días de conservación: el objetivo es controlar la calidad de la conservación : se deben observar como mínimo un 70% de espermatozoides vivos con una puntuación para motilidad de 3.
3. Control bacteriológico a los 3 días: el objetivo es controlar la eficacia del conservante antibiótico con agar listo para su empleo (flora total) e incubado durante 24 h a 37°C. El recuento no debe sobrepasar las 10000 UFC/ml.


