El recuento de espermatozoides
22-dic-2006 (hace 18 años 3 meses 11 días)
El recuento es muy importante ya que va a permitir determinar el número de dosis óptimo utilizables de un eyaculado. Este recuento debe ser preciso, especialmente en las técnicas de inseminación post cervical que se rentabilizan disminuyendo el número de espermatozoides por dosis. Ningún método es perfecto y es necesario reevaluar la técnica y el material utilizado periódicamente.
En la granja hay 2 métodos utilizables:
- Cámara de recuento
- Fotómetro
El objetivo es determinar el número de dosis con 3 mil millones de espermatozoides vivos.
Cámara de recuento
1. Uso de una cámara de Burker:
Material
Un envase graduado de 100 ml.
Solución de contaje: citrato de sodio (3,4%) tratada con formol.
Micropipeta automática de 1 ml con puntas de un solo uso.
Cámara de Bürker.
Preparación
Realizar una solución de 100 ml.
1 ml de semen puro.
99 ml de solución de contaje.
Agitar el frasco y depositar una gota sobre la cámara de recuento.
Recuento
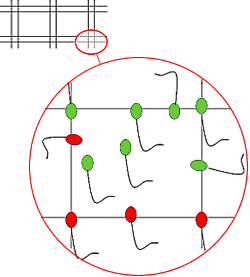 Contar los espermatozoides que hay en 40 cuadrados pequeños según la técnica presentada en la imagen para los espermatozoides limítrofes. En la imagen, nº = 7
Contar los espermatozoides que hay en 40 cuadrados pequeños según la técnica presentada en la imagen para los espermatozoides limítrofes. En la imagen, nº = 7
Contar a partir del margen superior izquierdo y desplazarse hacia la derecha, al final de hilera pasar a la inferior desplazándose hacia la izquierda.
Contar a continuación 40 cuadrados desde la parte inferior derecha de la cámara.
Después de haber contado dos series de 40, tomar una nueva muestra y contar otra vez dos series de 40 cuadrados.
El número elegido será la media de las 4 series de 40 cuadrados.
Cálculo
Total espermatozoides en (4 x 40 cuadrados) X 10.000.000 para obtener la concentración/ml.
Este número se multiplica a continuación por el número de ml recogidos para obtener el número total de espermatozoides en el eyaculado.

 2. Causas de errores y precauciones
2. Causas de errores y precauciones
- Preparación de la muestra:
Riesgo de error de 1 ml: El uso de una micropipeta de buena calidad es primordial.
- Preparación las portaobjetos y cubreobjetos:
Limpieza y secado.
Si la cámara de Burker no tiene un elemento específico de sujeción, hay que garantizar la adhesión del cubreobjeto al portaobjeto con saliva para que ésta no se desprenda.
- Recuento:
Espermatozoides en el límite de zona: hay que respetar siempre la misma norma.
Ajuste permanente del tornillo micrométrico: utilizar un microscopio de buena calidad.
Número de células que deben contarse:
1000 espermatozoides contados = 3% de error
100 espermatozoides contados = ?
Tiempo: 15 minutos mínimo.
El recuento celular sigue siendo el método de referencia.
El recuento con fotómetro
 Este método, muy utilizado hoy, es una adaptación de un método para evaluar la concentración de soluciones químicas. Es pues imperfecta ya que en este caso se mide la opacidad de una suspensión heterogénea.
Este método, muy utilizado hoy, es una adaptación de un método para evaluar la concentración de soluciones químicas. Es pues imperfecta ya que en este caso se mide la opacidad de una suspensión heterogénea.
1. Principio: diferencias entre los distintos materiales propuestos aunque el principio sigue siendo el mismo.
| Lámpara | Solución | Filtro | Analizador |
| Emisión de la radiación luminosa (varias longitudes de ondas diferentes). | Absorción de una parte de los rayos recibidos. | Selección de una longitud de onda. Las otras no atraviesan el filtro. | Analiza la diferencia entre la longitud de onda emitida y la recibida. |
2. Método:
| Verter 48 ml de solución de recuento de citrato de sodio (3,4%) en un recipiente graduado de 50 ml. |  |
| Depositar a continuación 2 ml de semen con la micropipeta automática. |  |
| Encender el aparato al menos 15 minutos antes de su utilización. |  |
| Verter solución de recuento (citrato de sodio) en una cubeta para efectuar la calibración. |  |
| Después de agitar la solución, verter la preparación en una cubeta. | 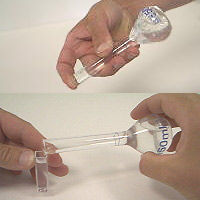 |
| Depositar la cubeta en el colorímetro y anotar el valor indicado. Lectura de la densidad óptica (DO) indicada. El tiempo entre el llenado de la cubeta y lectura no debe superar 30 segundos. |
 |
A partir de la DO leída por el aparato, determinar la concentración en espermatozoides por ml.
A continuación, según el volumen o el peso, determinar el número de espermatozoides presentes en el eyaculado.
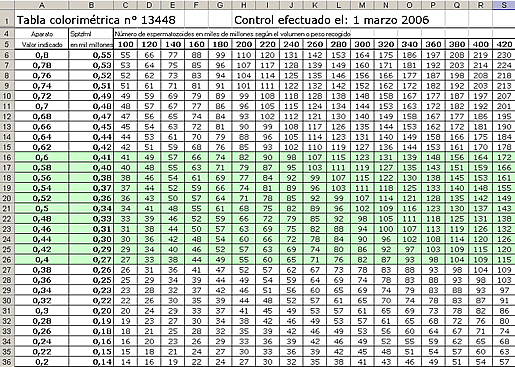
Tabla aparato nº 12505
| DO | Mil millones de Sptz/ml | DO | Mil millones de Sptz/ml |
| 0,8 | 0,709 | 0,5 | 0,463 |
| 0,79 | 0,700 | 0,49 | 0,454 |
| 0,78 | 0,692 | 0,48 | 0,446 |
| 0,77 | 0,684 | 0,47 | 0,438 |
| 0,76 | 0,676 | 0,46 | 0,430 |
| 0,75 | 0,668 | 0,45 | 0,422 |
| 0,74 | 0,659 | 0,44 | 0,413 |
| 0,73 | 0,651 | 0,43 | 0,405 |
| 0,72 | 0,643 | 0,42 | 0,397 |
| 0,71 | 0,635 | 0,41 | 0,389 |
| 0,7 | 0,627 | 0,4 | 0,381 |
| 0,69 | 0,618 | 0,39 | 0,372 |
| 0,68 | 0,610 | 0,38 | 0,364 |
| 0,67 | 0,602 | 0,37 | 0,356 |
| 0,66 | 0,594 | 0,36 | 0,348 |
| 0,65 | 0,586 | 0,35 | 0,340 |
| 0,64 | 0,577 | 0,34 | 0,331 |
| 0,63 | 0,569 | 0,33 | 0,323 |
| 0,62 | 0,561 | 0,32 | 0,315 |
| 0,61 | 0,553 | 0,31 | 0,307 |
| 0,6 | 0,545 | 0,3 | 0,299 |
| 0,59 | 0,536 | 0,29 | 0,291 |
| 0,58 | 0,528 | 0,28 | 0,282 |
| 0,57 | 0,520 | 0,27 | 0,274 |
| 0,56 | 0,512 | 0,26 | 0,266 |
| 0,55 | 0,504 | 0,25 | 0,258 |
| 0,54 | 0,495 | 0,24 | 0,250 |
| 0,53 | 0,487 | 0,23 | 0,241 |
| 0,52 | 0,479 | 0,22 | 0,233 |
| 0,51 | 0,471 | 0,21 | 0,225 |
Multiplicar la concentración por el número de ml recogidos (incluyendo el diluyente). Ejemplo: la DO es 0,6 lo que corresponde a una concentración de 0,545 mil millones/ml.
3. Puntos clave para conseguir un buen recuento con fotómetro:
3.1. Tener en cuenta que cada fotómetro es único y debe ser calibrado individualmente para los espermatozoides. La tabla de correspondencia entre la densidad óptica y la concentración es también específica para cada fotómetro.
3.2. Los eyaculados no son idénticos y lo óptimo sería tener una tabla de correspondencia individual para cada verraco.
3.3. La fotometría está pensada para medir soluciones y no suspensiones heterogéneas. Las medidas pueden estar falseadas por la presencia de otros elementos como restos celulares, sangre, tapioca... Para limitar estos errores todavía es preferible trabajar con la fracción rica.
3.4. El material es sensible y debe comprobarse y calibrarse regularmente: cambio de la lámpara (véase el fabricante), comprobación regular del filtro (520-550), estabilidad del circuito eléctrico sin otros aparato conectados, tapar y proteger del polvo el aparato. Es importante mantener el aparato encendido 10-15’ antes de cada lectura para tener una luz estable.
3.5. La fiabilidad del resultado indicado y la correspondencia con la concentración sólo es válida en la banda de densidad óptica del 40 al 60% (a veces del 20 al 80%, pero con riesgos). Por debajo de un 20% de absorbancia la muestra se diluye demasiado y es necesario concentrar la mitad. Por encima de un 80% de absorbancia la muestra se concentra demasiado, duplicar la dilución.
3.6. La dilución es la etapa más importante y la principal fuente de errores. Hay que utilizar un material preciso como la micropipeta automática y preferir siempre un volumen bastante elevado, como mínimo 1 ml de semen tomado del centro del eyaculado después de haberlo mezclado bien (sin sacudirlo).
3.7. La solución de contaje permite también hacer una medición de "blanco" para tarar el 0. Entre las distintas soluciones (cloruro de sodio, agua, diluyente...) es la solución de citrato de sodio que parece la más interesante (2,5 al 3,5%).
3.8. Las cubetas de lectura disponibles, almacenadas al resguardo del polvo (caja cerrada) ya que el polvo depositado sobre las caras transparentes falseará el recuento. Atención a las marcas de dedos: es preferible sujetar las cubetas con un tejido suave.
3.9. El semen es una suspensión y los espermatozoides se depositan bastante rápidamente. De ahí la necesidad de una sincronización precisa y realizable: el tiempo global entre la mezcla de la muestra y la lectura no debe sobrepasar 30’’:
- Llenar la cubeta.
- Invertir 4 o 5 veces la cubeta, sin sacudirla, para homogenizar.
- Colocar la cubeta en el aparato
- Leer tras 10’’ de estabilización.
- Retirar la cubeta, rehomogenizar y repetir la lectura, que no debe diferir más de un 1%.
4. El calibrado del fotómetro:
4.1. Tomar 10 eyaculados y preparar un dilución 1/25: los resultados de densidad óptica se compararán con las concentraciones obtenidas en el recuento en cámara de Burker:
| Nº | DO | Recuento celular * |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 | ||
| 5 | ||
| 6 | ||
| 7 | ||
| 8 | ||
| 9 | ||
| 10 |
* En millones/ml de recogida
4.2. A partir de la tabla y de una hoja de cálculo, establecer la recta de regresión:
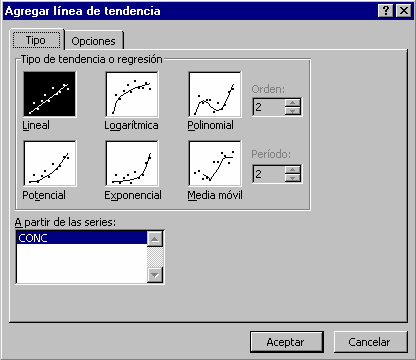
4.3. Obtener la ecuación de la recta de regresión con un coeficiente de regresión que debe tender hacia 1. Si se quiere ser más preciso se puede hacer la calibración probando distintas diluciones (1/10, 1/25, 1/50...) y tomar el que dé una recta de regresión con el coeficiente de determinación más elevado.
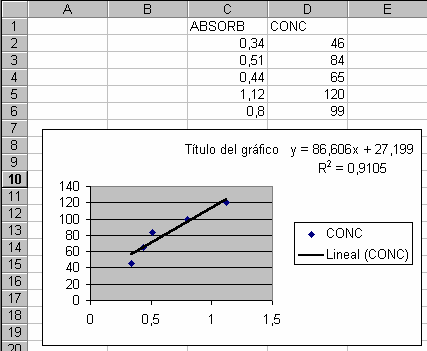
4.4. Construir la tabla de correspondencia en una hoja de cálculo introduciendo la ecuación obtenida.
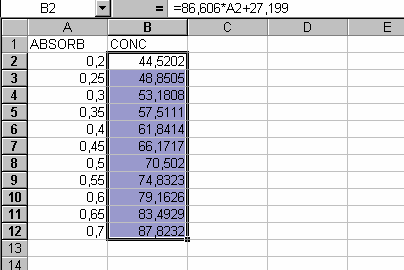
4.5. Editar el documento final con la correspondencia en mil millones de espermatozoides según el volumen o el peso recogido, indicando bien la zona de fiabilidad óptima entre 0,4 y 0,6.