PRRS: Etiología y signos clínicos
01-mar-2006 (hace 19 años 1 meses 9 días)
El síndrome reproductivo y respiratorio porcino (PRRS) es una enfermedad económicamente significativa cuyo coste estimado para la industria estadounidense alcanza aproximadamente 467 millones de euros al año. Los primeros brotes clínicos del PRRS descritos datan de finales de los años 80 en los Estados Unidos; sin embargo, se desconocía la etiología de la enfermedad. En 1990 se sucedieron brotes similares en Alemania y se propagaron por Europa durante 1991. En 1991 investigadores de Holanda y Estados Unidos identificaron el agente etiológico, el virus del síndrome reproductivo y respiratorio porcino (PRRSV). Actualmente, el PRRSV es endémico en la población porcina mundial; sin embargo, algunos países como Suecia, Suiza, Nueva Zelanda y Australia se encuentran libres de la enfermedad.
Etiología
El PRRSV es un virus RNA envuelto de cadena simple y polaridad positiva de aproximadamente 50-65 nm de diámetro del orden de los Nidovirales, familia Arteriviridae, género Arterivirus al igual que el virus del aumento de la lactato-deshidrogenasa del ratón, virus de la arteritis viral equina y virus de la fiebre hemorrágica del simio. Algunas de las propiedades de estos virus incluyen la capacidad de inducir viremia prolongada, infecciones persistentes y replicación en macrófagos. Al ser un virus envuelto, la supervivencia del PRRSV fuera del huésped viene afectada por la temperatura, pH y exposición a detergentes. El PRRSV puede sobrevivir durante largos periodos (>4 meses) a temperaturas entre -70°C a -20°C; sin embargo, su viabilidad disminuye al aumentar la temperatura. Se ha descrito recuperación del PRRSV durante 20 minutos a 56°C, 24 horas a 37°C y 6 días a 21°C. El PRRSV sigue siendo estable a un pH de entre 6,5-7,5; sin embargo, la contagiosidad se reduce a niveles de pH por debajo de 6 o por encima de 7,65. Los detergentes se muestran eficaces en la reducción de la contagiosidad del virus y los disolventes de lípidos, como el cloroformo y éter, son particularmente eficientes en la destrucción de la envuelta viral y en inactivar la réplica.
Respecto a la diversidad genética, hay dos prototipos importantes de PRRSV, del aislado europeo (virus de Lelystad) y el norteamericano (VR-2332). Además de diferencias entre los aislados, se ha determinado la existencia de una variación genética amplia dentro de ambos tipos de aislados, según lo confirmado por los análisis de nucleótidos y las secuencias de aminoácidos del marco abierto de lectura (ORF) del LV y del VR-2332. Las secuencias de aminoácidos para el VR-2332 respecto al LV son del 76% (ORF2), 72% (ORF3), 80% (ORFs 4 y 5), 91% (ORF 6) y 74% (ORF 7), y el análisis de la secuencia indica que los virus se desarrollan por mutación y recombinación al azar.
Signos clínicos
Los brotes de PRRS incluyen episodios de fallo reproductivo (abortos en el tercer trimestre, partos prematuros y niveles elevados de momificados, nacidos muertos y muertes neonatales) así como reducciones en el crecimiento y mortalidad elevada debida a problemas respiratorios.
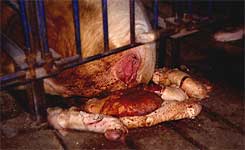 Los abortos en el tercer trimestre son una observación común después de una infección de una cerda gestante por el PRRSV. |
 Los partos prematuros consecuencia de una infección por el PRRSV provocan el nacimiento de lechones débiles, inrementando la mortalidad pre-destete. |
 Los momificados y nacidos muertos son secuelas comunes de una infección durante el tercer trimestre de gestación. |
 Fotografía de una camada infectada por el PRRSV con presencia de lechones débiles, momificados y nacidos muertos. |
Sin embargo, la intensidad de la enfermedad parece variar en función del aislado, y esta variación en la patogenia de la virulencia del PRRSV se ha observado en animales infectados de forma experimental. Varios estudios han mostrado como cerdos infectados de forma experimental con 9 aislados estadounidenses diferentes mostraban diferencias importantes en la enfermedad clínica, temperatura rectal y lesiones pulmonares micro y macroscópicas. En estos estudios, los animales infectados con aislados del LV de virulencia leve mostraron pirexia transitoria, disnea y taquipnea mientras que la infección con aislados altamente virulentos indujo respiración fatigosa, pirexia, letargia y anorexia. Además, varios estudios han mostrado que el impacto sobre el rendimiento reproductivo puede ser dependiente del aislado. Finalmente, el grado de PRRS clínico puede estar relacionado con una elevada concentración viral en sangre y tejidos, secundaria a la capacidad de los aislados de elevada virulencia de replicarse de forma más eficaz en el huésped. La infección de cerdos susceptibles con aislados altamente virulentos del PRRSV da lugar a largos periodos de viremia, aumento de la severidad de los signos clínicos y de la mortalidad así como una carga viral significativamente mayor en sangre y tejidos en comparación con los infectados con aislados de virulencia leve o atenuados.
Otros factores como la edad del animal y las coinfecciones bacterianas pueden afectar sobre la replicación vírica y sobre los signos clínicos. Estudios en los que se comparaban los efectos de la edad mostraron que los cerdos jóvenes (4-8 semanas de vida) infectados con el PRRSV tenían una viremia más larga y unas tasas de eliminación y replicación viral en los macrófagos mayores en comparación con cerdos de mayor edad (16-24 semanas de vida). Además, se ha determinado que algunos agentes bacterianos, como Bordetella bronchiseptica y Mycoplasma hyopneumoniae parecen aumentar la duración y severidad de la neumonía y lesiones pulmonares inducidas por el PRRSV. Por otro lado, la infección por PRRSV aumenta la susceptibilidad de los cerdos frente a la infección por Streptococcus suis tipo 2, aumenta la severidad de la infección por Salmonella choleraesuis, y, junto con la coinfección con el circovirus porcino tipo 2, aumenta el desarrollo del síndrome del desmedro (PMWS, post-weaning multi-systemic wasting síndrome). Por lo tanto, los veterinarios porcinos deben realizar investigaciones específicas en la explotación para poder determinar el papel del PRRSV y la identidad de agentes oportunistas presentes en el complejo de la enfermedad.
