Estudio y control de la patología seminal en porcino
13-feb-2006 (hace 19 años 2 meses 6 días)
Los verracos de un centro de inseminación tienen una gran cobertura de hembras cubiertas, con los sistemas tradicionales de inseminación artificial un verraco puede realizar entre 350 a 800 cubriciones/año, cualquier fallo no detectado con suficiente antelación puede repercutir muy negativamente en la productividad de la granja.
Para conseguir un inmediato diagnóstico del grado de fertilidad del eyaculado nos debemos apoyar en distintas técnicas de valoración seminal desarrolladas en el laboratorio. La técnica ideal para utilizar debe cumplir los siguientes requisitos: rápida, objetiva, sencilla y precisa, reunir todas estas cualidades en una sola técnica es imposible, por lo que debemos de apoyarnos en varias técnicas que interpretadas conjuntamente nos faciliten realizar un diagnóstico preciso. Sánchez et al. (1992) establecen una tabla de parámetros combinados que permiten una clasificación de eyaculados con la que se consiguen un incremento de 63 lechones más por cada 100 cubriciones realizadas.
El grado de alteración que puede sufrir el semen puede ser muy variable y con una repercusión también muy distinta. Se puede ver afectado solamente el rendimiento cuantitativo del semen y sea perfectamente utilizable, mientras que en otros casos el espermatozoide o plasma seminal sufran modificaciones que no permitan períodos prolongados de conservación, en otras ocasiones se ve afectada la capacidad fecundante disminuyendo los resultados reproductivos.
Podemos distinguir los siguientes estados de patología seminal:
- Disminución del número de espermatozoides en el eyaculado, bien por una bajada de volumen o concentración espermática. Los espermatozoides son totalmente maduros y con poder fecundante, solamente pueden afectar la fertilidad cuando el numero de espermatozoides por eyaculado no llegue al mínimo de espermatozoides por dosis (3 x109 espermatozoides), cuando supera estas concentraciones simplemente supone un trastorno en el rendimiento del centro de inseminación. El ejemplo mas típico que cursa con esta bajada de concentración espermática, es cuando se incrementa el numero de recogidas, que implica una bajada inmediata de volumen y concentración (Levis, 1986).
- Alteración del espermatozoide que imposibilita la fecundación, pudiendo afectar al eyaculado total o parcialmente y provocando fallos en gestación con un incremento de las repeticiones de 21 2 días. En este caso los espermatozoides pueden tener un grado de inmadurez (morfoanomalías espermáticas) o la célula espermática puede sufrir un deterioro en su estructura celular (membrana plasmática, acrosoma, formación de aglutinaciones o precipitaciones, inhibición de la motilidad) bien por alteraciones del plasma seminal o agresiones extrínsecas realizadas en la manipulación del laboratorio de inseminación. Se ha podido comprobar que inseminaciones realizadas con espermatozoides con distinto grado de madurez, determinan distintos desarrollos y viabilidad embrionaria que inducen mortalidad embrionaria con la consecuente reducción de tamaño de camada.
 |
 |
 |
|
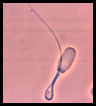
Espermatozoide con cola en látigo
|
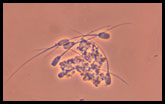
Aglutinación espermática
|
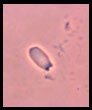
Espermatozoide sin cola
|
La utilización de técnicas microscópicas o de cualquier otro tipo (Cuadro 1) para valorar y clasificar los eyaculados destinados a realizar dosis seminales, son fundamentales para alcanzar buenos resultados de fertilidad. En el campo de la investigación cada vez son más frecuentes los trabajos que utilizan fluorocromos que nos permiten realizar estudios objetivos muy precisos sobre el estado de las distintas estructuras celulares del espermatozoide (membrana plasmática, acrosomía, condensación cromática, estado del tracto intermedio y cola). También se están consiguiendo avances muy importantes en la utilización de programas informáticos que permite analizar imágenes microscópicas, permitiendo cuantificar exactamente campos de visión donde se valoran la motilidad, morfología espermática, o espermatozoides teñidos con distintos colorantes o fluorocromos.
Los citómetros de flujo son equipos que a pesar de su elevado coste, son cada vez más utilizados en los laboratorios que trabajan semen, permiten estudios muy exactos de poblaciones espermáticas a partir de un altísimo número de células.
Cuadro 1. Técnicas de contrastación para valorar la calidad del semen de verraco
| Macroscópicas |
| Volumen Color |
| Microscópicas |
| % Motilidad Calidad de movimiento Concentración % Morfoanomalías Grado de aglutinación Pruebas de resistencia Test de resistencia osmótica Integridad de la membrana plasmática Grado de capacitación Determinación del grado de condensación cromática |
| Bioquímicas |
| pH Presión osmótica Fuerza iónica Determinación de acrosina Determinación de ATT (aspartato amino transferasa) Peroxidación lipídica Fosfolípidos de membrana Determinación de distintos péptidos, iones, enzimas |
| Análisis de imagen con software |
| Valoración de motilidad Valoración de morfología |
| Pruebas biológicas |
| Pruebas inmunológicas frente a determinados antígenos del semen Test de penetración heteróloga Test de penetración homóloga |
Los test de penetración homólogo (con ovocitos de ovarios de cerda de matadero) y heterólogo (ovocitos de hámster) son pruebas que requieren que el espermatozoide cumpla todas sus funciones: integridad celular, capacitación, penetración y decondensación. Aunque son pruebas muy caras son las que más se aproxima a la capacidad fecundante que tiene el espermatozoide in vivo.
