Además de la solicitud con un expediente completo (visto en los capítulos anteriores) existen otras alternativas para el registro de medicamentos veterinarios. La más frecuente es la solicitud de un genérico, aunque existen otro tipo de solicitudes menos habituales que se verán al final de este capítulo.
Un medicamento genérico es todo medicamento que tenga la misma composición cualitativa y cuantitativa en principios activos y la misma forma farmacéutica, y cuya bioequivalencia con el medicamento de referencia haya sido demostrada por estudios adecuados de biodisponibilidad (Real Decreto 1246/2008).

Es decir, debe contener la misma sustancia activa y en la misma cantidad que el medicamento en el cual se basa (medicamento de referencia). Debe asimismo administrarse por la misma vía y tratarse del mismo tipo de formulación (solución, suspensión, comprimido...). Ahora bien, estos dos requisitos no serían suficientes para garantizar la intercambiabilidad entre un genérico y el medicamento de referencia, ya que existen otros factores, como los excipientes que acompañan a la sustancia activa, el tamaño de partícula de ésta, el proceso de fabricación, etc., que pueden modificar la cantidad de medicamento que llega inalterado a la sangre en un tiempo determinado desde que se administra y por tanto, está disponible para llegar a los tejidos del organismo que nos interesan y ejercer su función. Si esta cantidad difiere significativamente entre dos medicamentos su efectividad será diferente (es decir, no serán bioequivalentes), y por tanto no podemos hablar de genéricos.
La gran ventaja del registro de medicamentos genéricos es que el solicitante no tendrá obligación de facilitar los resultados de las pruebas de inocuidad y de estudios de residuos ni los ensayos preclínicos y clínicos establecidos si puede demostrar que el medicamento es genérico de un medicamento veterinario de referencia (R.D. 1246/2008). Es decir, el laboratorio solicitante se ahorrará los elevados costes que supone el desarrollo del expediente de registro de un medicamento novedoso, lo cual repercute de forma directa en el precio del producto final.
Por lo que respecta a calidad químico-farmacéutica, los medicamentos genéricos están sometidos a los mismos requerimientos que los medicamentos de referencia y que todos los medicamentos en general, cumpliendo las Normas de Correcta Fabricación (NCF).
Por tanto, para el registro de un medicamento genérico no es preciso aportar datos sobre inocuidad ni estudios de residuos ni ensayos preclínicos y clínicos. La documentación a aportar sería la siguiente:
- Parte I: Datos administrativos.
- Parte II: Calidad.
- Bioequivalencia
- Estudios de toxicidad ambiental (ecotoxicidad)
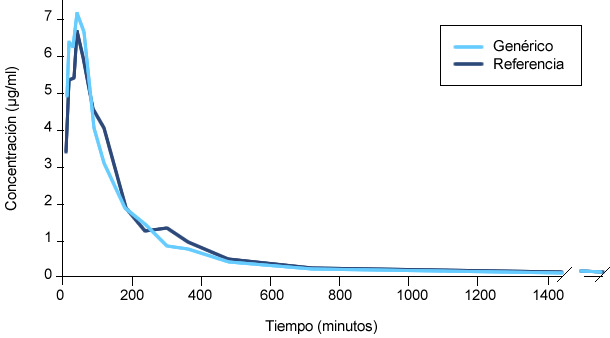
Por norma general, los estudios de bioequivalencia suelen realizarse con 28 animales. A la mitad de ellos se les administra el medicamento genérico y a la otra mitad, el de referencia. Después de un tiempo, a los animales que recibieron el medicamento genérico se les administra el de referencia y viceversa (diseño cruzado). Se toman muestras de sangre de todos los animales a diferentes intervalos de tiempo y a partir de la determinación de los niveles plasmáticos de la sustancia activa obtenidos, se calculan diferentes parámetros farmacocinéticos (AUC o área bajo la curva, Cmax, Tmax). El análisis estadístico de estos parámetros será el que nos permitirá discernir si ambos medicamentos son bioequivalentes o no.
Concentraciones medias de flunixin en plasma de cerdas tratadas con una formulación genérica y la de referencia a una dosis única de 2,2 mg/kg p.v. por vía intramuscular
Los estudios para la determinación de la ecotoxicidad ya los describimos en el capítulo dedicado a la Parte III (Inocuidad y residuos) del expediente de registro.
Los medicamentos genéricos veterinarios no podrán ser comercializados hasta transcurridos diez años (trece en medicamentos destinados a “especies menores”) desde la fecha de la autorización inicial del medicamento de referencia, ya sea en España o en cualquier otro país de la Unión Europea.
Otros tipos de solicitud
Solicitud híbrida
Solicitud de un medicamento veterinario respecto a un medicamento veterinario de referencia con una Autorización de comercialización en un Estado Miembro, pero que no cumple el criterio de genérico (por ejemplo, diferente forma farmacéutica, diferente uso terapéutico, etc.). En este caso, se deben presentar, además de los datos de calidad completos, sólo los datos de seguridad y de eficacia necesarios que avalen su uso.
Solicitud uso veterinario bien establecido en medicina veterinaria
El solicitante puede sustituir los resultados de las pruebas de inocuidad, de los estudios de residuos y de los ensayos preclínicos o clínicos por una documentación bibliográfica-científica adecuada, siempre que pueda demostrar que los principios activos del medicamento veterinario han tenido un uso veterinario bien establecido al menos durante diez años dentro de la Unión Europea y presentan una eficacia reconocida, así como un nivel aceptable de seguridad.
Solicitud con consentimiento informado
Solicitud para un medicamento de uso veterinario que posea la misma composición cualitativa y cuantitativa en principios activos y la misma forma farmacéutica que un medicamento veterinario ya autorizado para la que su Titular ha dado consentimiento al solicitante del medicamento veterinario, para usar sus datos en apoyo de la solicitud.

Se deberán presentar el consentimiento informado del titular para la documentación de calidad, seguridad, preclínica y clínica.


