Técnicas de diagnóstico de PRRS: elige la mejor estrategia para cada escenario
02-jun-2020 (hace 4 años 9 meses 29 días)
Los diagnósticos de PRRS han evolucionado a lo largo de los años e incluyen diversas valiosas opciones de pruebas. Del escenario para el que realizaremos la prueba dependerán tanto el tipo de animales a muestrear como el tipo de procedimiento de muestreo: ¿Deberíamos analizar cerdas, lechones, animales de engorde o todos ellos?; ¿estamos realizando un muestreo dirigido o un muestreo aleatorio de la población?; y ¿cuál debería ser nuestro tamaño de muestra? También debemos decidir el tipo de muestra: ¿estamos tomando suero, tejidos, fluidos orales o semen? Y, finalmente, no podemos olvidar todas las preguntas relacionadas con el estadio de la enfermedad en el momento del muestreo. ¿Cuándo aparecieron los signos clínicos? ¿esperamos que la prueba de diagnóstico detecte el virus, identifique la lesión o detecte anticuerpos? Finalmente, es fundamental que comprendamos las ventajas y las limitaciones de cada prueba de diagnóstico.
Comprender las opciones y elegir la estrategia de diagnóstico correcta para cada escenario para el que necesitamos muestrear de PRRS aumentará la efectividad de cualquier programa sanitario en las granjas.
Escenarios en los que tomamos muestras de PRRSV
El escenario más evidente es para investigar la enfermedad, cuando aparecen los síntomas de un posible brote de PRRS en una granja negativa o estable. En este caso, los veterinarios realizan la prueba para comprender la causa de los signos clínicos y el origen del patógeno que causa los problemas. Otro escenario muy común es cuando se monitorea la ausencia de PRRS en una granja previamente positiva e inestable que ha emprendido una estrategia de control o erradicación y quiere analizar su progreso. Finalmente, las pruebas de PRRS son extremadamente comunes para fines de vigilancia de enfermedades. En este último escenario, las pruebas se realizan en granjas negativas y normalmente requieren un mayor número de muestras para maximizar la confianza del estado libre de PRRS de la población.
Nuestros objetivos de diagnóstico guiarán la elección de la prueba
Históricamente, hemos clasificado las pruebas de diagnóstico de PRRS en 3 tipos:
-
Aquellas que detectan la lesión: observaciones post mortem e histopatología, que sólo pueden realizarse en un laboratorio bajo un microscopio. Las pruebas de detección de lesiones se usan con mayor frecuencia en los brotes de PRRS clínicamente obvios;
-
Los que detectan el virus: reacció en cadena de la polimerasa (PCR), aislamiento del virus (VI) y pruebas de inmunohistoquímica (IHC). La detección viral es la herramienta de diagnóstico más fiable para la confirmación temprana de la presencia del virus;
-
Los que detectan anticuerpos: Ensayo de inmunoabsorción ligado a enzimas (ELISA), ensayo inmunoperoxidasa en monocapa (IPMA) y ensayo de inmunofluorescencia indirecta (IFA). La confirmación inmunológica del contacto con PRRSV requiere un período de detección más prolongado, pero confirma la exposición cuando no se puede detectar el virus.
Las características de la prueba determinan su valor
Es muy importante revisar la SENSIBILIDAD (SE) y ESPECIFICIDAD (SP) al considerar cualquier prueba de diagnóstico. Conocer esta información ayuda a interpretar y actuar adecuadamente sobre los posibles resultados.
- SE: es la capacidad de una prueba de diagnóstico para identificar correctamente muestras realmente positivas. Una prueba con una SE baja tendrá demasiados resultados falsos negativos.
- SP: es la capacidad de una prueba de diagnóstico para identificar correctamente muestras realmente negativas. Una prueba con una SP baja tendrá demasiados resultados falsos positivos.
Opciones de diagnósticos en función del escenario de PRRS
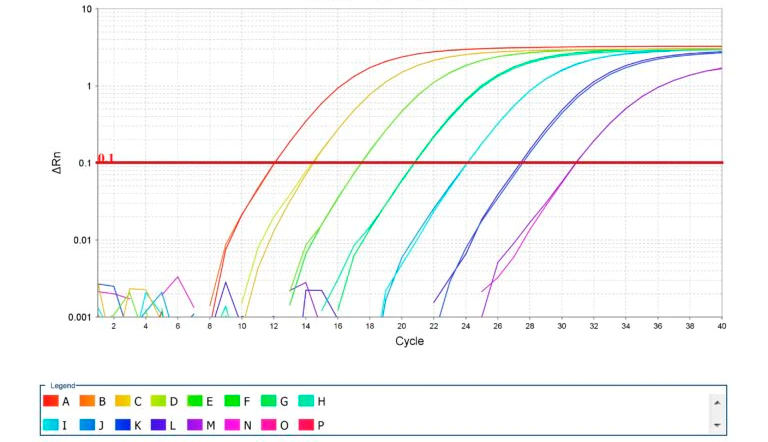
Todos los escenarios y las opciones de diagnósticos están resumidas en la tabla 1.
1. Investigación de brotes: En una granja que experimente un brote, el objetivo del protocolo de diagnóstico será confirmar la infección y, si es posible, caracterizar genéticamente la cepa. La participación temprana del veterinario en el brote ayudará a lograr estos objetivos de manera efectiva. Si hay cerdos con signos clínicos clásicos, se recomienda realizar un muestreo selectivo de estos animales para buscar lesiones macroscópicas. Después de identificar lesiones representativas (es decir, pulmones pesados no colapsados con apariencia marmórea) en la granja, se debe realizar una PCR e histopatología para confirmar el diagnóstico. A continuación, debería llevarse a cabo la secuenciación genética para identificar la cepa. La secuenciación es la clave para comprender la epidemiología (es decir, origen, residente o emergente) del posible nuevo virus a través de la comparación con otras cepas conocidas.
2. Monitorización de la enfermedad: Para minimizar el impacto negativo de la enfermedad debido a la inestabilidad de la producción en una granja PRRSV positiva, deben implementarse lo antes posible programas de control (seguidos algunas veces por la erradicación) para producir lechones negativos. Los objetivos del programa de diagnóstico en este caso serán demostrar parámetros clave que indican la estabilidad del PRRS (es decir, la aclimatación de la reposición, la inmunidad de la granja de cerdas y la producción de lechones negativos). La serología se usa para confirmar una buena exposición de la granja de reproductoras y la PCR se usa para confirmar la ausencia del virus en lechones recién nacidos y destetados. En estas condiciones, utilizamos pruebas con una alta SE (es decir, la menor cantidad de falsos negativos posibles). Debido a que estamos tratando con una granja donde la prevalencia esperada de lechones positivos al PRRS es muy baja o ausente, se requerirá una gran cantidad de muestras para confirmar el estado del PRRS con un alto grado de confianza. Suponiendo la ausencia de lechones clínicamente afectados, los lechones seleccionados al azar y las primerizas negativas recientemente introducidas dentro de la granja son las mejores poblaciones en las que realizar el muestreo. La mayoría de los tipos de muestra (es decir, suero, fluidos orales, fluidos de procesamiento y tejidos) son valiosos, pero es importante comprender las diferencias de SE y SP entre las pruebas al evaluar los resultados. Cuando sea posible, siempre debe considerarse la agregación de muestras (“pooling”), para que el análisis sea más asequible.
3. Vigilancia de la enfermedad: Al realizar la vigilancia de la enfermedad en granjas negativas, comúnmente seleccionamos pruebas con la SP más alta (es decir, la menor cantidad de resultados falsos positivos) como sea posible. Estas granjas (ejemplo, centros de inseminación o multiplicadores), en muchas ocasiones, deben documentar su estado de forma rutinaria. En el caso de las granjas de cerdas, la prueba ELISA es la mejor opción para mostrar la ausencia de exposición al PRRSV. Es asequible, rápida y tiene una buena SE y SP. Es común que estas granjas realicen una prueba serológica secundaria para determinar si sus resultados positivos inesperados (normalmente del 1 al 2% de las muestras totales) son positivos verdaderos o falsos. La prueba indirecta de anticuerpos de fluorescencia (IFA) o el ensayo de monocapa de inmunoperoxidasa (IPMA), ambas basadas en la tinción indirecta de monocapas preparadas en células infectadas, sirven como pruebas confirmatorias comunes para positivos inesperados al ELISA. La PCR como prueba de detección temprana se usa en: 1) fluidos orales antes de la entrega de las primerizas de reemplazo de mayor edad; y 2) muestras de suero o sangre de verracos en centros de inseminación.
Como resumen, al elegir las pruebas correctas, en el momento correcto, en los animales correctos, e interpretarlas correctamente aumentará la velocidad, precisión y rentabilidad de nuestras estrategias de diagnóstico de PRRS.
Tabla 1. Resumen de los escenarios y estrategias por diagnóstico
Investigación de un brote
- Estatus a PRRS de la granja
- Inestable a PRRS
- Transmisión activa del virus
- Nueva introducción de PRRSV
- Alta prevalencia de la enfermedad
- Objetivos del diagnóstico
- Detección de la infección
- Identificación de la cepa de PRRSV
- Animales
- Aquellos con sintomatología clínica
- Nacidos muertos
- Tipos de muestreos
- Muestreo dirigido
- Menor número de animales
- Muestras agrupadas (“pooled”)
- Muestra
- Tejido
- Suero
- Primera opción de diagnóstico
- Necropsia para identificar la lesión
- Pros
- “Muy rápido”
- En granja
- No es caro
- Contras
- SE/SP baja
- Segunda opción de diagnóstico
- PCR/secuenciación de virus para detectar/identificar la cepa de PRRSV
- Pros
- SE/SP alta
- Rápida, 24h
- Los resultados pueden cuantificarse (RT-qPCR)
- Contras
- Casos potenciales de falsos positivos debido a contaminación cruzada: asegurar un manejo de la muestra correcto (durante el muestreo y el procesado).
Monitorización de la enfermedad
- Estatus a PRRS de la granja
- Estable a PRRS
- Cepa PRRS autóctona de la granja
- Prevalencia baja de la enfermedad
- Objetivos del diagnóstico
- Monitorización de la estabilidad / control
- Monitorización de programas de erradicación
- Animales
- Lechones (recién nacidos y destetados)
- Reposición
- Tipos de muestreos
- Muestreo aleatorio/Número alto de animales
- Muestro dirigido/Número menor de animales
- Muestras agrupadas (“pooled”)
- Muestra
- Fluidos orales
- Suero
- Fluidos de colas (procesados)
- Fluidos de lenguas de lechones
- Primera opción de diagnóstico
- PCR para detectar el antígeno (RNA) desde ≈7 días post-infección
- Pros
- SE/SP alta
- Rápida, 24h
- Los resultados pueden cuantificarse (RT-qPCR)
- Contras
- Casos potencialmente falsos de positivos debido a contaminación cruzada: asegurar un correcto manejo de la muestra (durante el muestreo y el procesado
- Segunda opción de diagnóstico/opción alternativa
- ELISA para detectar anticuerpos (IgM, IgG, N) desde ≈14 días post-infección
- Pros
- Bajo coste por muestra
- Resultados en 2-4 días
- Confirmación laboratorial de la falta de exposición al virus
- Contras
- SP baja
- No puede diferenciar entre exposición a virus vacunal y virus campo
- Los resultados no pueden ser cuantificados
Vigilancia sanitaria
- Estatus a PRRS de la granja
- Granja negativa a PRRSV
- 1. Objetivos diagnósticos
- Asegurar el estado negativo
- Animales
 |
|
4. Tipos de muestreo
|
4. Tipos de muestreo
|
|
5. Muestra
|
5. Muestra
|
|
6a. Primera opción de diagnóstico (cerdas, nulíparas y lechones)
6b. Primera opción de diagnóstico (reposición)
7. Segunda opción de diagnóstico
|
6. Primera opción de diagnóstico
|
