Un enfoque distinto en la vacunación frente a influenza
27-nov-2018 (hace 6 años 4 meses 4 días)
Las vacunas contra la influenza porcina se parecen a las vacunas contra la gripe para humanos, pero no del todo
Las vacunas que actualmente se comercializan frente al virus de la influenza porcina (VIP) son, tradicionalmente, inactivadas (o muertas) y se administran vía inyección intramuscular (IM). Estas vacunas protegen al inducir anticuerpos frente a la principal proteína de la superficie viral, la hemaglutinina (HA). El punto débil de estos anticuerpos neutralizantes es que su objetivo son las partes más variables de la HA. Este es el motivo por el que las cepas de las vacunas para humanos se actualizan cada pocos años: para coincidir con las cepas circulantes (Dormitzer et al, 2011).
Las vacunas frente al VIP tienen similitudes con las vacunas muertas para humanos, pero también tienen diferencias esenciales. Mientras que las vacunas para humanos suelen contener antígenos purificados de la superficie del virus, sin adyuvantes, la mayoría de vacunas frente al VIP son preparaciones del virus entero con un adyuvante de base oleosa. En el caso de las vacunas frente al VIP, a diferencia de las humanas, la dosis antigénica y las cepas vacunales no están estandarizadas (Van Reeth and Ma, 2013). Debido a las diferencias antigénicas y genéticas entre los VIP europeos y norteamericanos, las vacunas de cada región geográfica se producen localmente y contienen cepas completamente distintas. La vacuna más ampliamente usada en el mercado europeo es trivalente y contiene H1N1 tipo aviar, H1N2 tipo humano y un VIP H3N2 de los años 2000 en combinación con un adyuvante a base de carbómero. También se usa a menudo una vacuna bivalente con un adyuvante oleoso. Se basa en una cepa H1N1 porcina tipo aviar y una H3N2 humana aislada hace más de 35 años. Vacunas similares en EEUU contienen cepas representativas de más de 3 linajes distintos de VIP H1 y uno o dos linajes de H3N2. Recientemente se ha lanzado, en ambos continentes, una vacuna monovalente basada en el virus pandémico H1N1 de 2009.
La complejidad de la selección de cepas para la vacuna frente a VIP
El VIP ha sufrido más cambios que nunca durante la última década y la ausencia de cambios en las cepas vacunales de VIP y en los protocolos se han convertido en un problema importante. Pese a que virtualmente todos los VIP han evolucionado sus HA a partir de virus que, en algún momento circularon en la población humana, la epidemiología de la influenza es mucho más compleja en cerdos que en humanos (Lewis et al, 2016). Las múltiples introducciones del virus de la influenza de los humanos a los cerdos, en distintos países, junto con el hecho de que los cerdos no viajan como los humanos, ha contribuido a una enorme diversidad genética y antigénica del VIP. Esto se ilustra en la figura 1 para el subtipo H3N2.
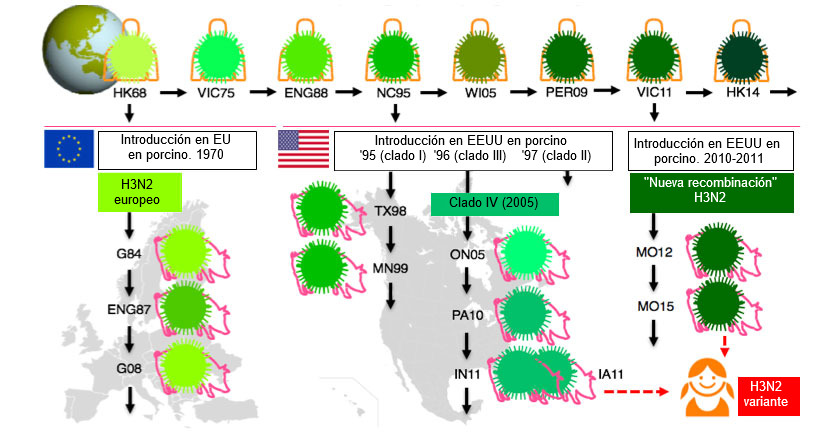
Los subtipos H1N1 y H1N2 de VIP todavía son más diversos. Hay tres linajes de H1 circulando simultáneamente en muchos países europeos: tipo aviar, tipo humano y el H1 pandémico de 2009. La secuencia de aminoácídos de sus HAs difiere hasta un 20-25% y hay una mínima reactividad cruzada serológica entre ellas. Además, los linajes y clados (subclasificación dentro de un linaje) prevalentes difieren en las distintas regiones europeas y todavía hay otros clados circulando en Norteamérica y Asia.
Cabe destacar que, a diferencia de las vacunas de gripe humanas, muchas de las vacunas comerciales frente al VIP muestran una protección relativamente amplia frente a las variantes de deriva dentro de un determinado linaje H1 o H3. Esto puede explicarse por la presencia de adyuvantes en estas vacunas, lo que aumenta la intensidad (cantidad) y la reactividad cruzada de la respuesta de anticuerpos. El desafío, en cambio, es cómo proteger a los cerdos frente a los múltiples virus H1 y H3 de varios linajes y clados que co-circulan. Esto requeriría vacunas multivalentes que contuviesen al menos 5 cepas H1 y H3 del VIP distintas. Las cepas apropiadas no sólo serian diferentes en distintos continentes y regiones, sino que también requerirían actualizaciones regulares. Estas vacunas VIP polivalentes son, tanto técnica como económicamente, difíciles de conseguir. Sería preferible el desarrollo de vacunas que pudiesen ofrecer una protección más amplia, y cruzada frente a distintos linajes y clados.
La vacunación primaria y de refuerzo heteróloga podría ofrecer una protección más amplia que una vacuna polivalente concordante
Los investigadores que trabajan con influenza están tratando de estimular la respuesta de anticuerpos hacia partes de la HA que son menos variables entre cepas. Los epítopes de estas partes han sido muy ignorados por las vacunas tradicionales y las estrategias vacunales porque son "subdominantes". Un enfoque que parece prometedor es la elección de dos vacunas antigénicamente muy distintas dentro del subtipo H1 o H3 para la vacunación primaria y la de refuerzo. Debido a que estas cepas muestran muy poca coincidencia en los epítopes inmunodominantes más variables, las células productoras de anticuerpos se redirigirán a los epítopes conservados, subdominantes. Nuestro grupo de investigación en la Universidad de Ghent ha demostrado el potencial de esta estrategia de "vacunación primaria y de refuerzo heteróloga" en un estudio con cerdos con vacunas inactivadas experimentales frente al VIP H3N2. Se inyectó una cepa europea H3N2 a cerdos no expuestos a influenza y, tras 4 semanas, se les inyectó una cepa H3N2 norteamerciana, o viceversa, como muestra la figura 2.
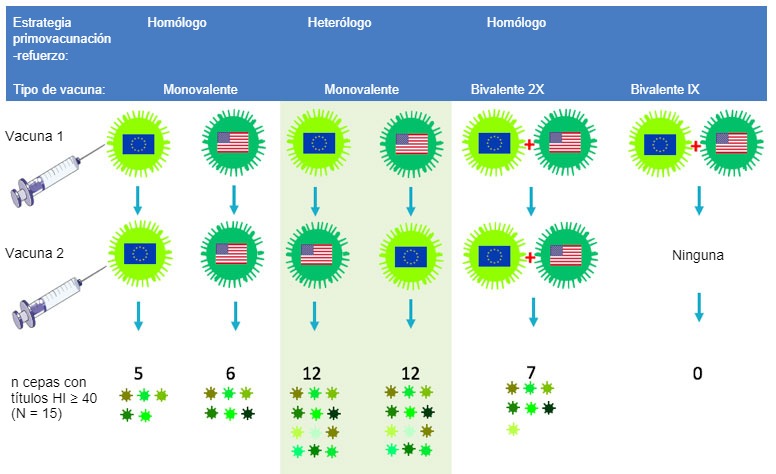
Los anticuerpos resultantes tenían una reacción cruzada con casi el 80% de un panel de 15 cepas diferentes de H3N2 de origen humano y porcino, en comparación con el valor inferior a 40% obtenido por el grupo control "primovacunación-refuerzo" homólogo (Van Reeth et al, 2017). Sólo se encontraron anticuerpos frente a ambas cepas vacunales tras la primovacunación-refuerzo heterólogo, o tras 2 inyecciones de una vacuna bivalente que combinaba ambas cepas, pero el alcance de la reactividad cruzada fue mucho mayor en el primer grupo. Usando diferentes vacunas para la vacunación primaria y la de recuerdo no sólo parece ser más inmunogénico que cualquiera de las vacunas existentes frente al VIP, también podría reducir la cantidad total de vacuna necesaria.
Es importante destacar que no funcionará bien cualquier combinación de cepas antigénicamente distintas del VIP H3N2 o H1N1. Además, el orden de administración de las cepas vacunales parece tener un efecto dramático sobre la respuesta de anticuerpos. Actualmente estamos tratando de deducir la base científica de estas observaciones y de mejorar aún más los regímenes de primovacunación-refuerzo con H3N2 así como con H1N1 y H1N2.
De las pruebas experimentales al uso en el campo
Por desgracia, todavía no se ha estudiado los efectos de realizar la vacunación primaria y la de recuerdo con distintas vacunas comerciales frente al VIP, por lo que todavía no podemos recomendar un protocolo de vacunaciones primaria y de refuerzo para las condiciones de campo. Este enfoque alternativo requerirá una mentalidad más abierta por parte de los vacunadores. Además es improbable que un único protocolo de primovacunación y recuerdo sea adecuado para animales de todas las edades. Sin embargo, creemos que algunos protocolos concretos pueden mejorar algunos de los problemas que nos encontramos para realizar una vacunación efectiva frente al VIP. La vacunación de lechones con cepas distintas de las del campo y de las utilizadas para vacunar a las cerdas pueden, hasta cierto punto, evitar el efecto de los anticuerpos maternales. Además es probable que la vacunación repetida de cerdas alternando cepas, sea más inmunogénica que utilizar la misma cepa repetidamente. Idealmente, también debería tenerse en cuenta la inmunidad activa preexistente para definir los protocolos. De hecho, tanto las cerdas como las nulíparas suelen haber sido previamente infectadas con una o más cepas del VIP. Se ha demostrado que esta inmunidad previa mejora y, en muchos casos, amplía la respuesta de anticuerpos a la vacuna muerta, especialmente si la cepa vacunal es diferente de las que han causado las infecciones anteriores.
La política de actualizar regularmente las cepas vacunales frente al VIP no sólo es poco práctica, también tiene limitaciones. No debemos olvidar que el éxito de la vacunación dependerá de muchos factores además de la concordancia de la cepa vacunal, como el historial de infecciones por influenza, el adyuvante y la dosis antigénica de la vacuna (Van Reeth and Ma, 2013). Estos otros factores son probablemente, más importantes en porcino que en humanos.
Agradecimientos
La investigación sobre influenza en el laboratorio de las autoras cuenta con el apoyo del Fondo de Investigación Especial de la Universidad de Ghent, el Servicio Público Federal para la Salud, Seguridad de la Cadena Alimentaria y el Medio Ambiente de Bélgica y la Comisión Europea.
