Técnicas laboratoriales para evaluar la respuesta celular inmune en el cerdo
26-jun-2018 (hace 6 años 9 meses 5 días)
Actualmente se utilizan varias técnicas laboratoriales avanzadas para evaluar la respuesta inmune celular en el cerdo, ya sea utilizando células inmunes de la sangre (células mononucleares de sangre periférica, PBMC) o células inmunes derivadas de órganos periféricos como el timo, linfonodos, bazo, intestino, pulmón y médula ósea. Estas técnicas han mejorado mucho en veterinaria y actualmente pueden emplearse en investigaciones experimentales o de campo. La citometría de flujo también se usa en oncología de pequeños animales.
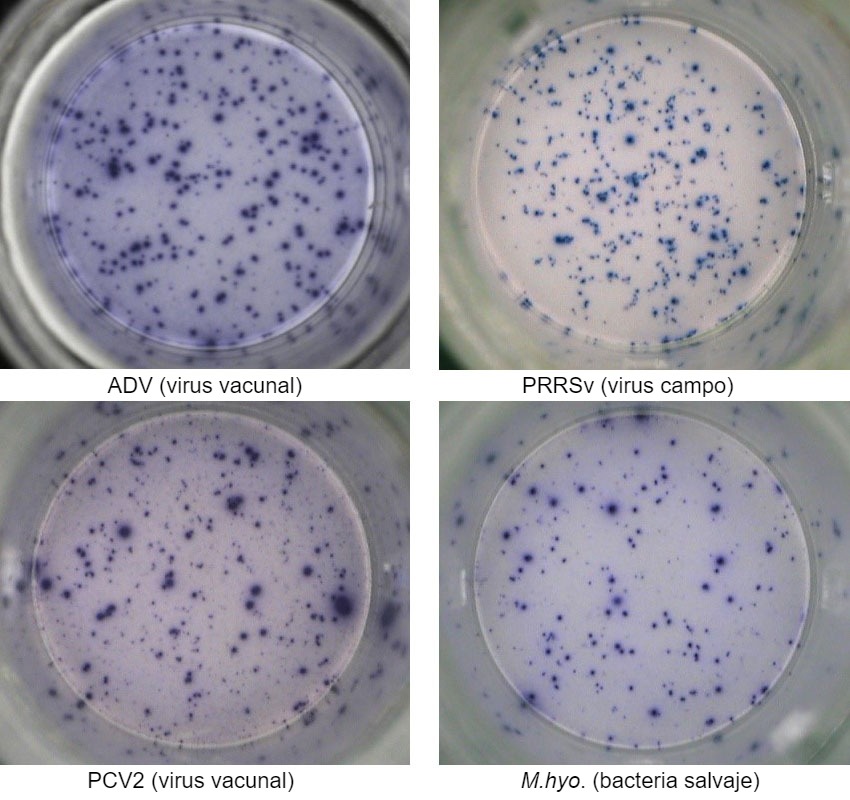
Una de las técnicas más utilizadas es el ensayo ELISPOT de IFN- γ mediante el cual se puede cuantificar el número de células secretoras de IFN-γ con una sensibilidad elevada mediante su estimulación con un antígeno viral (p.e. PRRSv, PCV2, ADV) o antígenos micoplasmales/bacterianos (p.e. Mycoplasma hyopneumoniae, Escherichia coli).
Se aislan las PBMC de sangre entera de animales que han tenido contacto con el patógeno, por vacunaciones previas y/o infecciones naturales, y se cuantifican los linfocitos T reactivándolos con un antígeno del mismo patógeno, o el propio patógeno entero (p.e. el virus entero).
Este ensayo puede dar información relevante sobre el estado de activación del sistema inmune del animal. De hecho, la inducción específica mediante virus o bacterias sobre las células de memoria y las T efectoras se detecta mediante la secreción de IFN-γ a nivel celular, visualizado en 96 pocillos.
Mediante el uso de ELISPOT puede monitorizarse la reactividad inmune a lo largo del tiempo comparando formas de vacunación (p.e. intramuscular vs intradérmica sin aguja), también pueden compararse programas vacunales o realizarse infecciones con patógenos emergentes para evaluar la respuesta de los animales infectados y la eficacia de nuevas vacunas en términos de protección y de protección cruzada.
La respuesta inmune celular se evalúa mediante el recuento de los puntos producidos por la secreción de IFN-γ por cada célula individual y se suele expresar como número de células secretoras de IFN-γ por cada millón de células analizadas. Si la muestra es positiva, significa que el animal ha estado expuesto al antígeno viral o bacteriano en el campo y que, por lo tanto, ha desarrollado inmunidad con células T de memoria que confieren un grado de protección frente a una exposición posterior al mismo patógeno y/o protección cruzada frente a variantes del patógeno.
La citometría de flujo es una técnica sensible y específica que permite identificar (inmunofenotipado) y cuantificar las subpoblaciones de células inmunes en la sangre periférica (PBMC) o células aisladas de tejidos u órganos inmunes que se tiñen con anticuerpos conjugados con fluorocromo que reaccionan con los principales marcadores inmunes intracelulares o de superficie.
Por lo tanto, pueden observarse y monitorizarse los cambios en estos subgrupos durante tratamientos experimentales específicos o en tratamientos de campo, como vacunaciones o la administración de inmunoestimulantes u otros fármacos, o las infecciones naturales o experimentales. Normalmente, los marcadores más utilizados para la citometría de flujo son las moléculas CD (clúster de diferenciación) expresadas en la superficie de las células inmunes, mediante las cuales es posible identificar varios subgrupos de monocitos (p.e. CD172, CD14, CD16, CD163) y linfocitos (CD3, CD4, CD8, CD27, CD1, CD2, CD16, CD14, CD25, CD79).
El estado de activación de estas células también puede determinarse mediante tinción intracelular de moléculas relacionadas con la activación y la secreción de moléculas como las citoquinas proinflamatorias (p.e. IL-1, TNF-α, IL-6), las inmunocitoquinas (p.e. IL-2, IFN-γ, IL-10) y los factores de expresión (p.e. FoxP3).
De este modo, tras una infección, y utilizando diversas tinciones, pueden identificarse y estudiarse subconjuntos inmunológicos polifuncionales capaces de producir múltiples citoquinas simultáneamente. Estas parecen ser las células relevantes capaces de regular y eliminar patógenos y ofrecer protección frente a ellos.
![<p>Figura 2. Ejemplos de citometría de flujo para detectar fenotipos de células inmunes cuantificadas como porcentaje de valores absolutos [número de células/ml de sangre]) en cerdo PBMC: a-c) Subpoblaciones de linfocitos T: CD3+CD4+CD8- = Linfocitos T helper (Th) CD3+CD4+CD8+ = células T de memoria CD3+CD4-CD8+ = linfocitos T citotóxicos (CTL) d-e) subpoblaciones de monocitos pro-inflamatorios: CD172+CD14+CD16+ CD172+CD16+CD163+ CD172+CD14+CD163+ f-g) CD4+CD25+FoxP3+ = linfocitosT reguladores (Tregs).</p>](https://www.3tres3.com/3tres3_common/art/mx/2978/citometria-de-flujo_232989.jpg)
La linfoproliferación tras una estimulación in vitro con activadores mitogénicos policlonales (inespecíficos) y monoclonales (p.e. específicos para virus o bacterias) puede ser una manera fácil de evaluar la reactividad de las células T cuando el animal está sujeto a tratamientos que puedan alterar la respuesta a mitógenos o antígenos patogénicos que activen la proliferación e induzcan un cambio de células quiescentes a células proliferantes activadas (es decir, linfoblastos).
La linfoproliferación puede evaluarse mediante un ensayo MTT (incorporación y cambio de color de un reactivo por las células en proliferación) pero también por citometría de flujo, por cuantificación de los linfoblastos (células de gran tamaño) y/o incorporación de reactivos fluorescentes de proliferación tras la estimulación invitro durante 2-5 días.
La tecnología de tetrámetros ha sido utilizada en cerdos para la cuantificación por citometría de flujo de linfocitos T citolíticos/citotóxicos de memoria antígeno-específicos CD8+ y, más recientemente, para la cuantificación de células B de memoria antígeno-específicas.
Se basa en el uso de macromoléculas fluorescentes cargadas con antígenos que son expuestas a una población mixta de células inmunes para que interactúen con las células B y T, que reconocen selectivamente al antígeno y presumiblemente son responsables de la eficacia de la respuesta celular y la eliminación/reducción del patógeno en el cuerpo del animal. Se trata de un método muy específico y sensible, que puede detectar cantidades pequeñas de células de memoria B y T. Por ejemplo, se ha desarrollado para detectar linfocitos T citotóxicos CD8+ específicos para el virus de la fiebre aftosa (FMDv) y el de la gripe porcina (SIV), y linfocitos B de memoria específicos para PRRSv.
Los ensayos de citotoxicidad utilizan linfocitos T efectores citolíticos/citotóxicos (E) aislados previamente que son incubados durante 3-4 días en 96 pocillos con células diana (T) a diferentes proporciones (E/T); la eficacia de la citolisis proporciona información sobre el potencial inmune de las células T efectores contra células diana in vivo potencialmente infectadas.
