El sistema inmune y la inmunidad en los cerdos: la red de neuroinmunidad
30-abr-2018 (hace 6 años 11 meses 20 días)
Es bien sabido que hay una compleja red de señales que implica al sistema inmune y al neuroendocrino, que juega un papel crítico en la modulación de la respuesta inflamatoria e inmunológica ante peligros ambientales (p.e. patógenos, factores nutricionales y/o ambientales) que implican una respuesta sistémica.
El objetivo es el mantenimiento de la homeostasis, el equilibrio dinámico en el que los cambios continuos establecen las condiciones óptimas para la supervivencia. La comunicación de los múltiples sectores garantiza el mantenimiento de la homeostasis y, por lo tanto, de la salud.
El sistema inmune, endocrino y el sistema nervioso central se comunican a través de vías anatómicas y hormono-neuropéptidas.
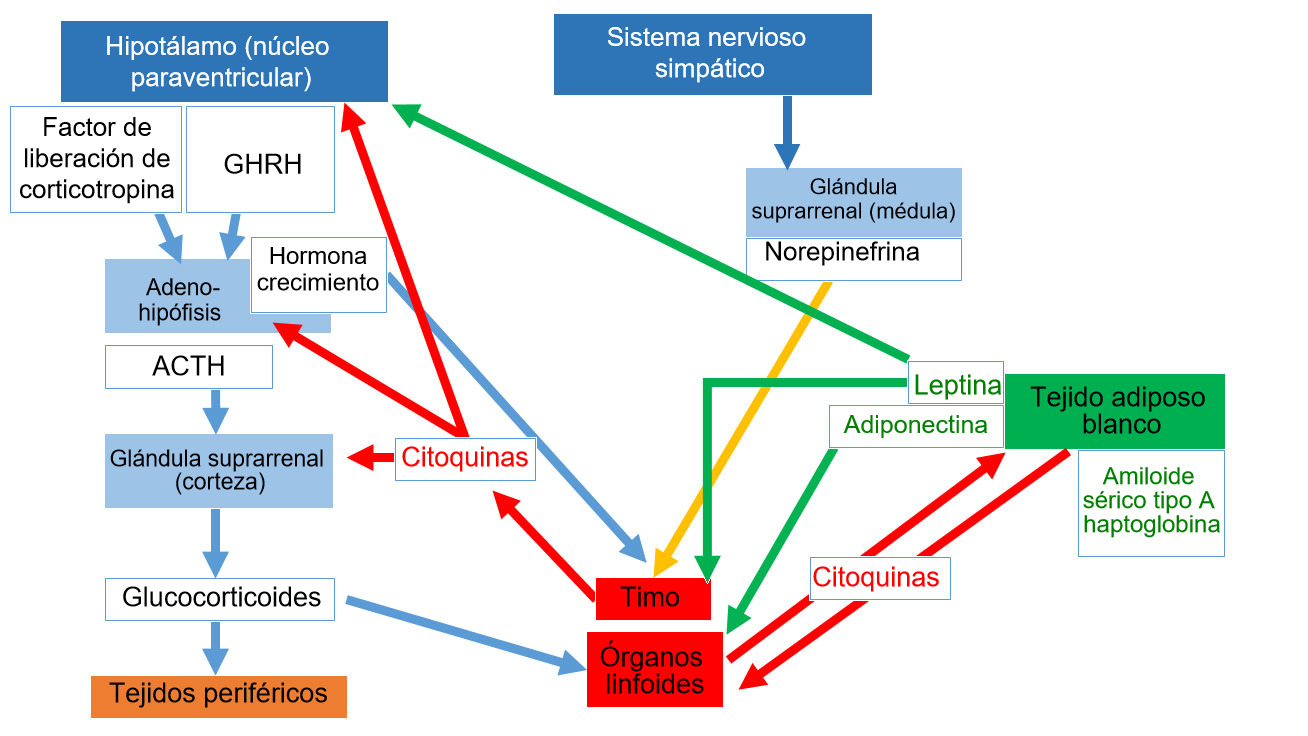
Los nervios eferentes del sistema nervioso simpático inervan los órganos linfoides primarios y secundarios; se ha demostrado que la adrenalina y la noradrenalina activa el eje hipotálamo-hipófisis-suprarrenal (HPA - hypothalamus-pituitary-adrenal) y actúan sobre los receptores β2 adrenérgicos leucocíticos.
Las células inmunes expresan receptores para muchas hormonas (por ejemplo, hormona adrenocorticotrópica, prolactina, hormona de crecimiento (Growth Hormone GH), leptina, glucocorticoides, estrógenos y testosterona, neurotransmisores y neuropéptidos como VIP, sustancia P, norepinefrina, somatostatina y neuropéptido Y). Del mismo modo, los tejidos endocrinos y nerviosos muestran receptores específicos para las citoquinas derivadas del sistema inmune.
Dentro de este marco, también está claro que las funciones de las células inmunes pueden ser alteradas por las hormonas neuroendocrinas y que las células inmunes tienen la capacidad de producir hormonas con una respuesta neuroendocrina funcional.
Las hormonas y las citoquinas, en particular las citoquinas proinflamatorias y reguladoras, son los principales actores de esta conversación coordinada. Su acción se traduce en una mejora de la inmunidad innata, un control de la inflamación con un aumento en la eficacia de la respuesta inmune. De hecho, se inicia también en respuesta a un desafío patógeno para restablecer la homeostasis. Por el contrario, una desregulación de esta respuesta neuroinmune puede afectar negativamente a la respuesta inmune contra los patógenos y la eficiencia metabólica.
En este sistema de "verificación y equilibrio", la evidencia emergente apunta a un papel fundamental de la microbiota intestinal. La microbiota intestinal interactúa estrechamente con el principal sistema neuroendocrino del cuerpo que controla varios procesos corporales en respuesta al estrés, el eje hipotalámico-pituitario-adrenal (HPA). Esta interacción es de importancia fundamental ya que varios trastornos del eje microbiota-intestino-cerebro se pueden asociar con la desregulación del eje HPA y del sistema inmune intercorrelacionado.
La activación del eje HPA y la secreción de glucocorticoides es una de las principales vías neuroendocrinas para controlar la inflamación local y sistémica.
Sin embargo, la prolactina y la GH también están involucradas en el desarrollo y la eficacia de la respuesta inmune. Son señales que facilitan la proliferación, diferenciación y función de las células inmunocompetentes hacia estímulos antigénicos específicos mediante una acción endocrina y paracrina. De hecho, ambas hormonas, que son idénticas a las hormonas de las glándulas endocrinas, son sintetizadas, almacenadas y secretadas por células inmunes.
El tejido Adiposo Blanco desempeña un papel fundamental en la red de neuroinmunidad que vincula el estado nutricional, el metabolismo y el equilibrio energético para mantener la homeostasis corporal. Los productos que se sintetizan principalmente en el tejido adiposo se conocen como adipocinas, e incluyen factores antiinflamatorios y proinflamatorios, como las citoquinas clásicas, pero también hormonas específicas. Las principales hormonas, la leptina y la adiponectina, también se han identificado como actores importantes en la intercomunicación entre el sistema endocrino y el sistema inmunitario.
La leptina no solo regula la ingesta de alimentos y el metabolismo, sino que también estimula la proliferación y la supervivencia de precursores linfoides y el desarrollo de células T en el timo. También puede mejorar la respuesta Th1 aumentando la producción de IL-2 e IFN-by por las células T y los macrófagos.
La adiponectina incluye múltiples isoformas y es la adipocina más expresada. La adiponectina, de alto peso molecular, actúa principalmente como un regulador antiinflamatorio mediante la supresión de la diferenciación y la activación clásica de los macrófagos M1 mediante regulación negativa de las citocinas proinflamatorias, es decir, TNF-α e IL-6, actuando sobre los receptores 1 de adiponectina. Las isoformas de menor peso molecular parecen jugar un papel proinflamatorio al aumentar la actividad de las moléculas proinflamatorias. (Tong et al., 2011; Gomez et al., 2011) (figura 1)
Varios factores estresantes de la producción intensiva de cerdos, como las prácticas de manejo, factores de estrés ambiental, factores nutricionales, el destete, las mezclas de animales, las peleas y el transporte pueden influir negativamente en la respuesta inmune en términos de eficiencia funcional.
Es evidente que las primeras semanas de vida constituyen el período más crítico para los lechones porque el desarrollo del sistema inmune y su eficiencia aumentan progresivamente. De hecho, durante el período neonatal, los lechones pueden estar expuestos a factores estresantes físicos y psicológicos y a infecciones que pueden influir directamente en la eficacia de la respuesta inmune.
El destete es uno de los eventos más estresantes que puede predisponer a disfunciones del sistema inmune e intestinal, comprometiendo seriamente la salud, el crecimiento y el consumo de alimento, particularmente durante la primera semana después del destete.
Del mismo modo, las infecciones son los principales factores que contribuyen a la reducción del rendimiento en los animales de abasto durante el crecimiento. Las infecciones persistentes/subclínicas también pueden afectar negativamente al rendimiento del crecimiento influyendo en el eje hormonal, el metabolismo tisular y la eficiencia nutricional.
Durante la infección, la activación del eje HPA y la secreción de glucocorticoides pueden influir tanto en la gravedad como en el impacto metabólico de la infección.
De hecho, una inflamación incontrolada, con daño tisular potencial, depende de una interacción compleja entre los niveles de glucocorticoides, su actividad periférica y, principalmente, los niveles y la persistencia de citoquinas proinflamatorias (TNF-a, IL-1β, IL-6, IL -15).
El eje HPA, la activación/desregulación del eje del factor de crecimiento insulínico tipo 1 (IGF1) y los niveles alterados de citoquinas sistémicas pueden inducir cambios metabólicos. Al comienzo de la infección/inflamación, varios cambios metabólicos (aumento de GH) pueden favorecer una respuesta inmune innata eficiente (energía desviada hacia la activación del sistema inmune). A continuación, se produce un desacoplamiento entre los niveles de GH e IGF-1 con supresión del eje GH, resistencia hepática y esquelética a GH e inhibición de la actividad de IGF-1 en los tejidos periféricos (Soendergaard et al., 2017). Además, los niveles elevados de glucocorticoides y citoquinas proinflamatorias (es decir, IL-1, TNF-α e IL-6) inducen a una reducción de la ingesta de alimento, un balance energético negativo con catabolismo tisular, degradación de proteínas y aminoácidos y una reducción de la biodisponibilidad y secreción de oligoelementos (p. ej., Zn y Cu).
MOSTRAR_ANIMACIO[741]
Tabla 1. Señal principal de la comunicación inmune-neuroendocrina
| Hormonas | Glucocorticoides |
|
| Hormona del Crecimiento (GH) |
|
|
| Leptina |
|
|
| Adiponectina |
|
|
| Citoquinas | IL-1, TNFa, IL-6 |
|
