El sistema inmunitario y la inmunidad en el cerdo: Reconocimiento de patógenos
08-ago-2017 (hace 7 años 7 meses 23 días)
Los sistemas innatos de reconocimiento celular se basan en proteínas superficiales o intracelulares de células epiteliales, neutrófilos, macrófagos y células dendríticas y en receptores citoplásmicos solubles. Todos estos receptores son generalmente llamados PRRs (Receptores de Reconocimiento de Patrones) y se unen a moléculas PAMPs (Patrones Moleculares asociados a Patógenos) expresadas solamente por el patógeno (lipopolisacáridos, carbohidratos y lipoproteínas bacterianos, peptidoglicanos, ARN, ADN, etc.) así como por la flora comensal.
Reconocimiento de patógenos por el sistema inmune innato
TLR (receptores tipo Toll). Se han identificado diez miembros diferentes en el cerdo. Son capaces de reconocer los productos bacterianos fuera de las células y el ácido nucleico viral dentro de la célula. Así, algunos TLR se localizan en compartimentos intracelulares para reconocer el ácido nucleico viral o bacteriano. Otros TLRs están en la superficie celular y reconocen productos bacterianos (lipoproteínas, peptidoglicanos, lipopolisacáridos).
RLRs Receptores parecidos a RIG-I (Gen inducible por ácido retinoico I). Son receptores citoplasmáticos que reconocen dsRNA viral.
Proteínas NOD (Dominio de oligomerización por unión de nucleótidos) Son PRRs citosólicos que cooperan con TLRs en el reconocimiento de productos bacterianos.
CLR (Receptores de lectina de tipo C) son una familia de receptores de superficie que incluye colectinas, pentraxinas, selectinas, dectinas y receptores de manosa.
Las proteínas pertenecientes al sistema del complemento y las proteínas de fase aguda son capaces de actuar como un receptor soluble de reconocimiento: fragmento C3, proteína de unión a manosa (MBP), surfactantes, proteína C reactiva (CRP).
La activación mutua de células a diferentes niveles tisulares, células epiteliales y endoteliales y, especialmente, células inflamatorias e innatas, es la primera barrera física y funcional contra patógenos desencadenando la respuesta inflamatoria.
Tabla 1: Sistemas de reconocimiento innato del patógeno.
| RECEPTORES | ACTIVIDAD DE RECONOCIMIENTO | ||
| Grupo de TLR (membrana o intracelular) | Reconocimiento de productos bacterianos y de hongos | TLR1 | Lipopéptidos (bacteria y micoplasmas) |
| TLR2 | Lipoproteínas y proteoglicanos (gram+) Lipopéptidos (micoplasmas) LPS (Leptospira) Lipo arabino manano (micobacteria) Lipopéptidos (micoplasmas) (gram+) Zimosano (hongos) |
||
| TLR4 | LPS (gram-) Proteína F de RSV HSP60 (Chlamydia) |
||
| TLR5 | Flagelina (muchas bacteria) | ||
| TLR6 | Regula el TLR2 Lipopéptidos (micoplasmas) Lipopéptidos (micoplasmas) (gram-) Zimosano (hongos) |
||
| TLR9 | CpG DNA bacteriano | ||
| TLR10 | Desconocido | ||
| Reconocimiento de productos de virus | TLR3 | dsRNA | |
| TLR7 TLR8 |
ssRNA. Se restringe a pDCs y no se expresa en cDCs | ||
| TLR9 | CpG DNA de virus. Se restringe a pDCs y no se expresa en cDCs | ||
| Familia CLRs (membrana) |
Selectinas, dectina 1,2 |
Reconoce el dominio de carbohidratos del patógeno e induce la fagocitosis o la activación del inflamosoma, con la producción de citoquinas pro-inflamatorias, en particular, dirigiendo la respuesta inmune hacia la finalización Th1 o Th17. | |
| RLRs (intracelular) |
RIG-1 |
Vincula el ARNsc durante la replicación de ARN del virus, induciendo la producción de citoquinas proinflamatorias y IFN tipo I y confiriendo un estado antiviral a las células infectadas. | |
| Proteínas NOD (citoplasmático-intracelular) | NOD1 NOD2 |
Interacción con componentes microbianos (porciones de proteoglicanos) a través de su región específica. Los NOD porcinos se expresan intensamente en los nódulos linfáticos mesentéricos y en los tejidos linfoides asociados al intestino (GALT), manteniendo su papel en la respuesta inmune innata contra las infecciones bacterianas. | |
| APPs (Proteínas de fase aguda) (soluble) |
Proteína C-Reactiva (CRP) | Producida en el hígado, se une a los residuos de fosfatidilcolina presentes en la pared de algunas bacterias y hongos, activando el sistema del complemento de manera clásica y aumentando la fagocitosis por macrófagos (fagocitosis mediada por opsonina). | |
| Lectina de unión a manosa (MBL) | Es una colectina del grupo de lectinas capaz de unir azúcares que contienen manosa, reconociendo así un gran número de virus, bacterias, hongos y protozoos. MBL es capaz de activar el sistema del complemento de una manera clásica o C1-independiente que promueve la fagocitosis mediada por opsoninas. |
Sistemas específicos de reconocimiento de patógenos
Las células inmunitarias específicas B y T tienen receptores que reconocen determinantes específicos de antígeno (epítopos) del patógeno.
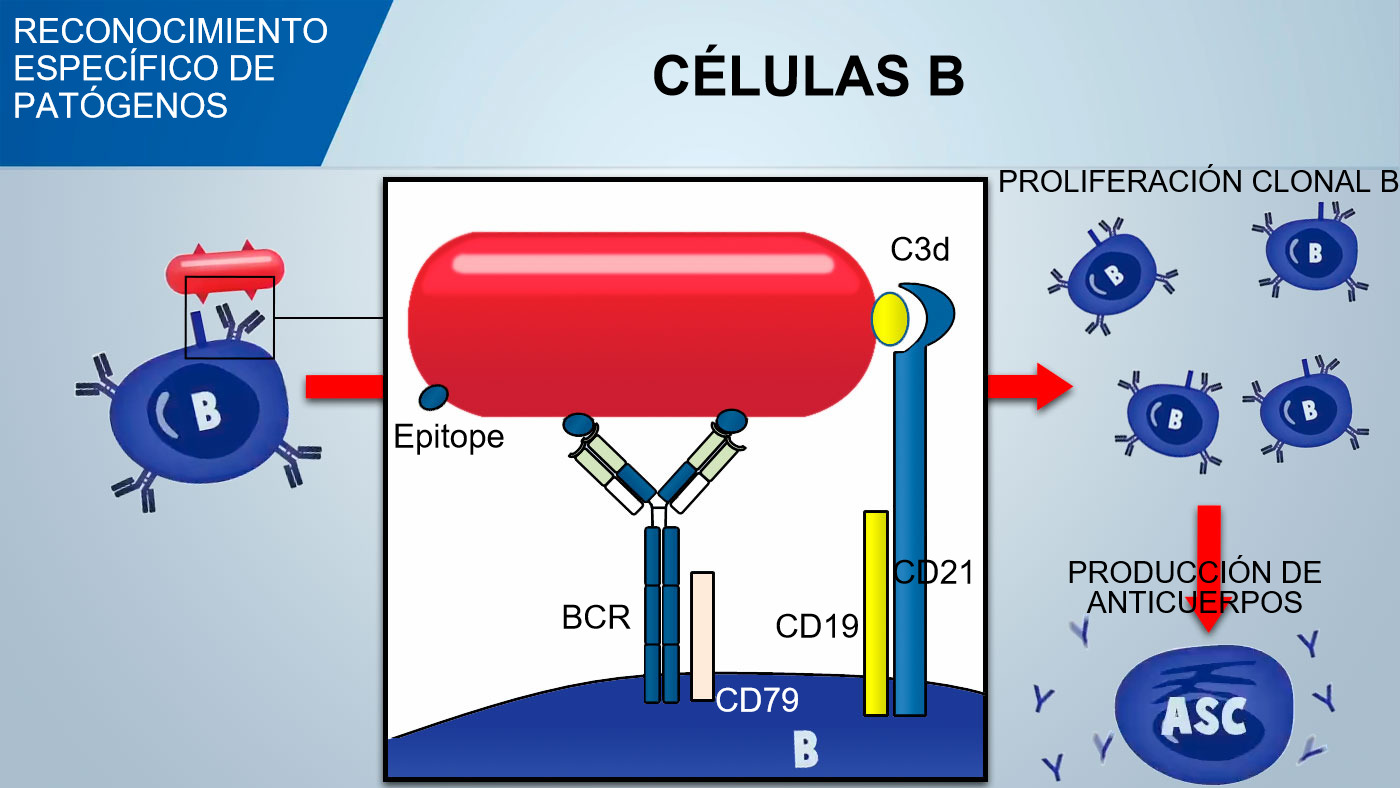
Los linfocitos B naïve (no activados) tienen múltiples receptores de superficie llamados BCR (receptor de células B) constituidos por una inmunoglobulina de superficie, IgM o IgD, específica para un antígeno solamente. Durante el desarrollo de las células B en la medula ósea se crea, por recombinación genética, un enorme repertorio de BCRs, y por consiguiente de células B, para poder reconocer un enorme número de antígenos específicos sobre los patógenos.
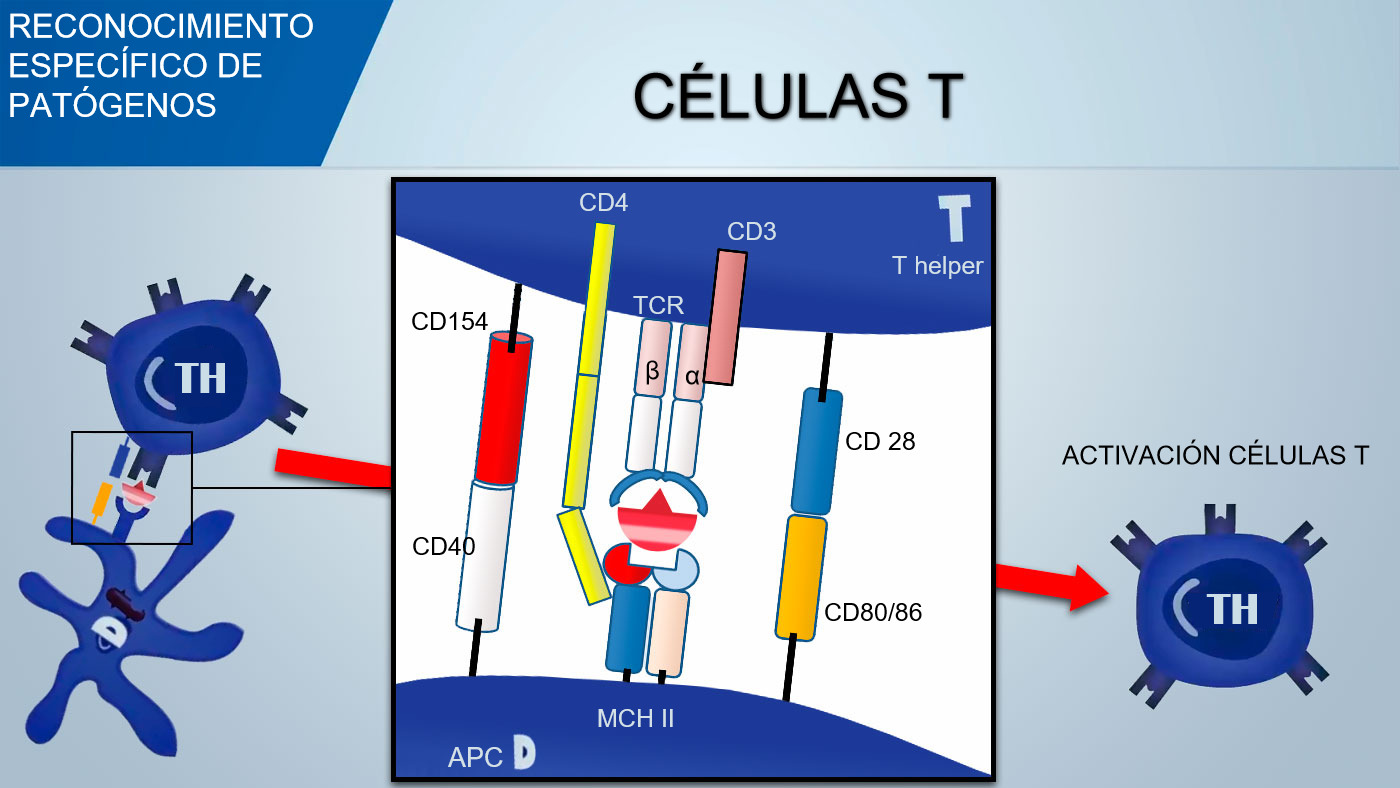
El receptor de células T (TCR) de linfocitos T cooperadores (Thelper) y linfocitos T citotóxicos está constituido por dos cadenas α y β. El TCR de los linfocitos T γδ está constituido por dos cadenas γ y δ. Con un mecanismo similar se produce la variabilidad del reconocimiento antigénico de TCR en linfocitos T.
Las células B reconocen los determinantes antigénicos nativos del patógeno y la señal se transduce dentro de la célula mediante la activación de una glicoproteína asociada (CD79α / β). Una vez internalizado el complejo antígeno-BCR, las células B procesan el antígeno y lo presentan en asociación con MHC II a los linfocitos T colaboradores. La coestimulación entre células B y T es esencial para la activación de las células B y para desencadenar una formación eficiente de anticuerpos. Una coestimulación eficaz requiere también una señal mediada por un complejo CD21 / CD19 que reconoce el fragmento del complemento (C3d) sobre el patógeno.
Por el contrario, las células T reconocen determinantes de antígenos procesados y presentados por APC (Células Presentadoras de Antígeno) en asociación con MHC (Complejo Mayor de Histocompatibilidad).
MHC II son moléculas presentes principalmente en la superficie de APC profesionales, tales como células dendríticas maduras, macrófagos inflamatorios activados y células B activadas. A su vez, el MHC I presenta antígenos endógenos a linfocitos T citotóxicos.
En cerdos, los genes de MHC (conocidos como SLA: "Antígeno Leucocitario Porcino") están en el centrómero del cromosoma 7. Los setenta genes (haplotipos) fueron definidos por primera vez en 1970 y se distribuyen en 3 clases:
- SLA I que codifica las moléculas de MHC I expresadas en la mayoría de las células nucleadas excepto las neuronas y los trofoblastos. Las moléculas de MHC I están asociadas y presentan antígenos intracitoplásmicos (por ejemplo, antígenos virales) a células T CD8 +. Las moléculas de MHC I están constituidas por una cadena pesada α (altamente polimórfica) y dos β2 ligeras llamadas β2-microglobulina.
- SLA II: Las moléculas del MHC clase II se expresan en linfocitos B, en APC profesionales y en algunas subpoblaciones de linfocitos T independientemente de su estado de activación. Las moléculas de MHC II están asociadas con antígenos procesados (fagocitados y degradados en péptidos) dentro de las APC. Las moléculas de MHC II consisten en una cadena α y una β.
- SLA III: Son genes que codifican para elementos del complemento, citocinas, etc.
Para activar el linfocito Th, la señal mediada por el reconocimiento TCR del complejo antígeno-MHC debería estar asociada con la señal mediada por la unión de moléculas de coestimulación superficial: el CD28 (en células T) se une a CD80 (en APC) o CD86 (en células B), y el CD40 (en APC) se une a CD154 (en células T). Esta coestimulación aumenta la producción de citocinas para la proliferación de células T (IL-2) y también da lugar a la diferenciación de Th mediada por citoquinas.
