Caso clínico: Proceso respiratorio multifactorial en transición y cebo
28-mar-2017 (hace 8 años 6 días)
Descripción de la explotación
Se trata de una granja de 1700 reproductoras con reposición externa. Las primerizas se aclimatan en la granja 60 días antes de su cubrición. Las primerizas son ELISA positivas, PCR negativas a PRRS y llevan 2 vacunas vivas. La tasa de reposición es del 50 %.
La granja es PRRS positiva estable. Las cerdas se vacunan en sábana cada cuatro meses con vacuna viva de PRRS y vacuna de Aujeszky. Las reproductoras se vacunan de E. coli, Parvo y Mal Rojo en ciclo.
Es una explotación antigua pero con sucesivas reformas que permiten un mejor control y manejo de los animales. La alimentación de las cerdas es pienso en harina y el semen se compra fuera de la explotación.
Los lechones son vacunados a 21 días de vida frente a Circovirus y Micoplasma. El destete se realiza a los 23 días de media y un peso medio de 6,5 kg.
Inicio del caso
Comienzan a aparecer casos de disnea en transición, con toses persistentes. El número de animales retrasados, o “colas”, es alarmante (rozando un 6 %) y con un porcentaje de bajas por encima del 4 %. No presentan una buena respuesta a la medicación (amoxicilina a 300 ppm y florfenicol a 80 ppm en pienso).
La clínica respiratoria se agrava considerablemente a la entrada a cebo (4% bajas), aparecen animales caquécticos y con necrosis de la punta de las orejas. Incluso algunos de ellos muestran la postura de “perro sentado” y entre un 16 y 20 % muestran fuerte disnea y anorexia.
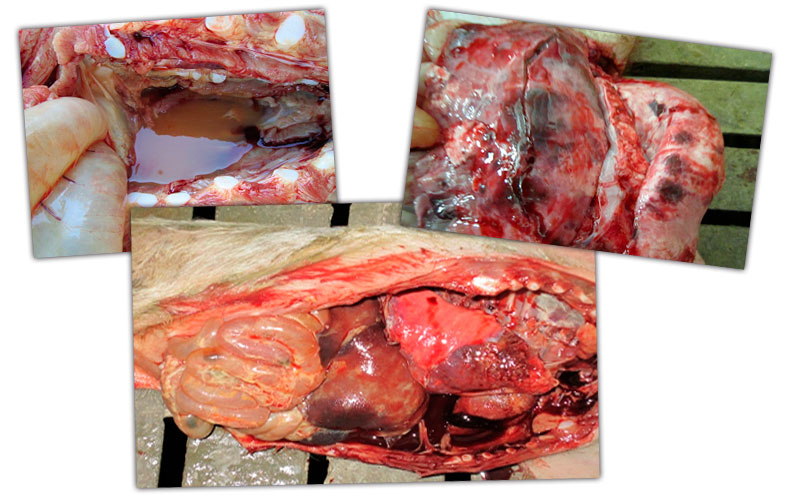
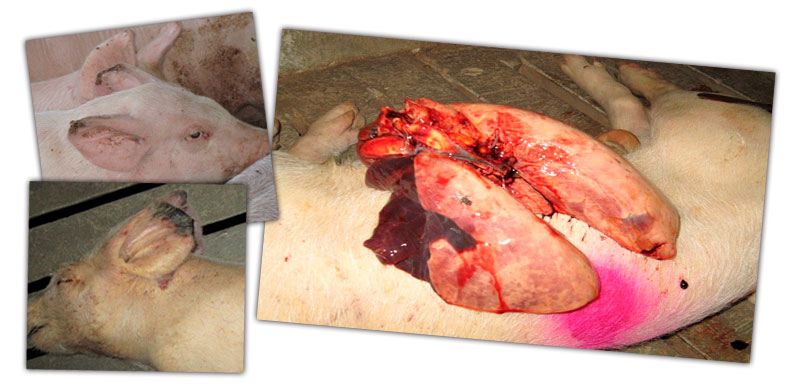
Se debe realizar un diagnóstico diferencial considerando las lesiones y la sintomatología presente.
Para determinar nuestro problema clínico, además del diagnóstico patológico, fue clave el desglose de los diferentes agentes ambientales y de manejo, así como su repercusión en procesos respiratorios.
Por las lesiones que observamos en la necropsia entendimos que estábamos ante un complejo respiratorio multifactorial.
El complejo respiratorio porcino
El Complejo Respiratorio Porcino (CRP) es un proceso multifactorial donde se combina la interacción del patógeno y el hospedador con las características del ambiente.
Entre los agentes involucrados en el CRP encontramos:
Agentes primarios: PRRS, Influenza, PCV-2, Aujeszky y Mycoplasma hyopneumoniae
Agentes secundarios: Streptococos suis, Actinobacillus suis, Actinobacillus pleuropneumoniae, Pasteurella multocida y Bordetella bronchiseptica. Mycoplasma hyopneumoniae puede también actuar como agente secundario.
Los elementos ambientales y de manejo que pueden incidir en el complejo respiratorio se relacionan en la tabla 1.
Tabla 1. Repercusión de factores ambientales y de manejo en procesos respiratorios.
| Factor | Óptimo | Efecto |
| Temperatura | 25-40 kg PV ⇒ 18-22 ºC 40-100 kg PV ⇒ 15-22 ºC |
Exceso y defecto repercuten en GMD, IC y predisponen a la aparición de procesos patológicos. |
| Ventilación | <0,2 m/s | Un exceso predispone a procesos patológicos. |
| Densidad | 20-30 kg ⇒ 0,3 m2 30-50 ⇒ 0,4 m2 50-85 ⇒ 0,55 m2 85-110 ⇒ 0,65 m2 |
Al menos cumplir la legislación (cuanto mejores condiciones, más eficiente). |
| Tamaño de grupo | <20 animales/cuadra | |
| Tolvas | Buena regulación a la entrada (no exceso de pienso en vaso), vaciarlas al menos 2 veces/semana para evitar exceso de finos. | |
| Orientación naves | Este-Oeste | Se consigue un mejor ambiente en verano y en invierno. |
| Aislamiento y ventanas | Un correcto aislamiento mejora los índices productivos y evita procesos patológicos | |
| Fosa de purines | En algunos casos se recomienda poner algo de agua para evitar corrientes | |
| Conducciones de agua | Limpiadas con ácidos orgánicos para evitar crecimiento de "biofilm" junto con el sistema de medicación | |
| Contaminantes ambientales | NH3 ⇒ <20 ppm CO2 ⇒ <3000 ppm CO ⇒ <10 ppm H2S ⇒ <0,5 ppm |
Estos agentes, junto con el polvo, incrementan la sensibilidad a la aparición de procesos respiratorios |
Protocolo de abordaje
Tras evaluar la clínica y las lesiones, hicimos un abordaje integral para averiguar qué agentes jugaban un papel más importante en el desarrollo del proceso.
Para determinar los agentes implicados en nuestro caso realizamos las siguientes analíticas:
Serología
- Lechones no encalostrados para valorar una posible circulación de PRRS en gestación. 10 sueros
- Lechones retrasados de más de 21 días de vida en maternidad, para valorar la existencia de recirculación de PRRS en maternidad. 10 sueros
- Lechones de 6 y 9 semanas de vida para comprobar la dinámica de la enfermedad en transición. 10 sueros por grupo de edad.
Análisis microbiológico, antibiograma e histología:
- Envío de pulmones a laboratorio: 10 y 12 pulmones cada 2 o tres semanas.
Resultados
Serología PRRS
En el análisis serológico obtuvimos un resultado PCR negativo en animales no encalostrados y un PCR positivo en el 100 % de los animales retrasados a 21 días de lactación siendo también positivo a PCR el sangrado a 6 y 9 semanas de edad. Todo ello muestra que teníamos una infección en maternidad y su siguiente recirculación en transición. Sin embargo, no se observaba ningún proceso reproductivo en granja.
Análisis microbiológico
En el cultivo de tejido pulmonar aislamos únicamente un patógeno oportunista (Aerococcus viridans), que no cuadraba con la patología. Este fallo sucedió por enviar muestras de animales medicados, ya que cuando se padece un proceso clínico en la explotación, los animales siempre son tratados vía pienso hasta que recibimos el antibiograma.
Tratamiento
Al revisar el trabajo en granja observamos que no se seguía un flujo de animales Todo Dentro-Todo Fuera (TD-TF), sino que muchos de los animales retrasados se mantenían más de 35 días en paridera debido a que no alcanzaban el peso de venta comercial de 6 kg. Para intentar corregir este problema, identificamos a los animales por semanas con crotales de diferentes colores para evitar que se rompieran los flujos.

Además de revisar el manejo de los lechones en paridera se realizó la vacunación en sábana de la granja con una vacuna viva de PRRS. También se estableció un protocolo de bioseguridad donde se controlaron las entradas de camiones de carga, veterinarios y personal de mantenimiento.
Sin embargo, después de realizar todo este protocolo, seguimos teniendo problemas en transición y cebo. Ante la pobre respuesta a los antibióticos, sospechamos que había algún otro proceso vírico asociado al PRRS.
En la granja de madres no teníamos problemas, y seguíamos sin tenerlos, por lo que entendimos que las medidas tomadas hasta el momento (vacunación de PRRS, mejora en la bioseguridad) no eran suficiente en este caso. Por ello realizamos un segundo estudio de factores de riesgo y factores predisponentes.
Segundo abordaje
- Reforzamos las medidas de limpieza de salas. Cambiando protocolos de desinfección y lavado.
- Se continuó el flujo estricto TD-TF en las transiciones para intentar desplazar el virus PRRS.
- Se estableció el uso de mantas térmicas y cañones a la entrada a cebo para evitar las fluctuaciones de temperatura y que la sala no descendiera de 24 grados.
Tras todas estas medidas de refuerzo, conseguimos que el flujo de animales en granja fuera negativo a PCR de PRRS en maternidad y transición. Aun así seguía habiendo un número de “colas” en transición del 4 % (respecto al 6 % inicial).
Continuaron los problemas respiratorios a la entrada en cebo, pero los animales mostraban una buena respuesta a los antibióticos. Aun así, seguía habiendo una gran dispersión de peso. Pensamos que las fuertes variaciones de temperatura podían ser un factor de estrés, desencadenando un proceso multifactorial.
Nos planteamos volver a analizar a los lechones y comprobar que no presentasen más patologías, como influenza, y que éste fuese el patógeno primario que haya hecho que la transición tuviese problemas bacterianos secundarios y un proceso respiratorio crónico.
Tabla 2: Análisis de influenza mediante fluidos orales (Test PCR).
| Hemaglutinina | Neuraminidasa | |||
| Muestra | H1 | H3 | N1 | N2 |
| s/n | + | - | + | - |
La muestra dio un resultado positivo para el serotipo H1N1.
Tratamiento
Incluimos vacuna y revacuna de reproductoras en sábana, y posteriormente en ciclo, de gripe y seguimos con la implementación estricta del flujo TD-TF de lechones en granja y en transición. La idea era que la inmunidad pasiva que pasase de la madre a los lechones nos proporcionase una menor recirculación del virus y por lo tanto su ratio de transmisión se redujese significativamente consiguiendo así un flujo negativo.
Los flujos continuos con mucha diferencia de edad siempre son muy complejos en cuanto a la incidencia de patologías respiratorias.
Meses después, cuando llegaron los lechones de madres vacunadas y siguiendo un flujo adecuado de animales, conseguimos corregir el problema en las transiciones y en cebo. Redujimos de manera notable el gasto en medicación en fase 2 y fase 3 y las bajas se redujeron a niveles inferiores al 2,5 % en transición y al 2 % en cebo. El control de la influenza hizo que los patógenos secundarios tuviesen menos capacidad para originar lesiones más graves en el pulmón.
Por ello cuando realizamos el abordaje de un problema debemos de monitorizar la pirámide hasta que encontremos cuál es el patógeno que juega un papel principal en el inicio y el desarrollo del proceso infeccioso. De este modo aprendimos que la presencia de un patógeno junto con malas condiciones ambientales hace que el problema se intensifique.
Conclusiones
- Es necesario realizar un abordaje integral, para poder alcanzar un diagnóstico diferencial correcto. Ver y contrastar que patógenos juegan un papel importante en la clínica que observamos en la granja.
- La analíticas laboratoriales son una herramienta, no el diagnostico.
- El manejo de los flujos de animales en sistemas TD-TF hace que nuestros animales no padezcan infecciones de otros animales de diferentes edades (la mezcla de edades es un gran problema). Es necesario establecer estructuras de manejo que limiten los ciclos continuos y, en la medida de lo posible, flujos de gran tamaño que funcionen en sistema TD-TF. Es la única manera de limitar procesos infecciosos.
- Corrección de los factores ambientales (reducen el estrés de los animales, por lo que su capacidad de defensa es mayor): aportar a los animales las condiciones de bienestar óptimas en temperatura ambiente, ventilación y calidad del agua.
- La mayoría de procesos clínicos que padecen los cerdos son multifactoriales por lo que la resolución clínica pasa por la modificación de distintos aspectos.
