Inmunidad de la mucosa y E. coli
04-nov-2016 (hace 8 años 5 meses 20 días)
La diarrea post-destete es una de las principales causas de pérdidas económicas en producción porcina. Se caracteriza por una elevada incidencia de diarrea y una reducción del crecimiento atribuibles a cepas enterotoxigénicas de E. coli. Sucesos como un destete temprano y brusco, entre 17 y 28 días de vida, generan un enorme estrés, lo que comporta una perturbación en la microbiota intestinal, la fisiología y la función inmune de la mucosa. La respuesta inmune de la mucosa intestinal es una de las áreas que ha recibido más atención en los últimos 5 años. El epitelio de la mucosa está formado por las células epiteliales, también conocidas como enterocitos, que recubren el tracto gastrointestinal. Su salud no sólo es importante para el crecimiento y el desarrollo del lechón por su función de secreción y absorción sino porque forman el mayor órgano inmune del cerdo y son la primera respuesta ante los microorganismos en el intestino.
Las células caliciformes que forman parte de la mucosa secretan moco y mucinas que proporcionan la barrera inicial (figuras 1 y 2) (Varum et al. 2010 y Pelaseyed et al. 2014). Las células epiteliales de la mucosa también aportan mucinas a esta barrera (Maynard et al. 2012 y Chase et al. 2012). Esta barrera también contiene péptidos antimicrobianos (AMP) producidos por los enterocitos (figura 2). Estos AMP son inducidos por la microbiota del tracto intestinal y por las células natural killer (NK) y LTi (figura 2) (Chase et al. 2012). Los AMP (también conocidos como péptidos de defensa del hospedador, HDPs) son una importante familia de moléculas que ayudan a formar una barrera química para limitar la infección en las superficies epiteliales y atacar a las bacterias invasoras. En cerdos se han identificado y caracterizado más de 30 HDPs (Maynard et al. 2012). Los AMPs son péptidos catiónicos relativamente pequeños y se encuentran básicamente en las superficies mucosas y en las células fagocitarias. Su estructura y actividad antimicrobiana es variable y pueden diferenciarse funcionalmente. La concentración de algunos HDPs aumenta como respuesta a la inflamación o infección microbiana. La IgA secretora (sIgA) se produce cuando se secreta IgA dimérica por las células plasmáticas de la lamina propia y se transporta a la superficie mucosa de las células epiteliales (figura 2) (Maynard et al. 2012). La IgA secretora tiene un papel importante en la inmunidad de la superficie de la mucosa al aglutinar a los agentes infecciosos, dificultando su adhesión a las células epiteliales y neutralizando toxinas. La capa mucosa interna junto con los AMP y sIgA forman una "zona letal" que pocos patógenos o comensales pueden penetrar (figura 2). Esta "zona letal" junto con las uniones estrechas, que tejen los enterocitos, forma una "barrera" frente a E. coli y otros parógenos entéricos.
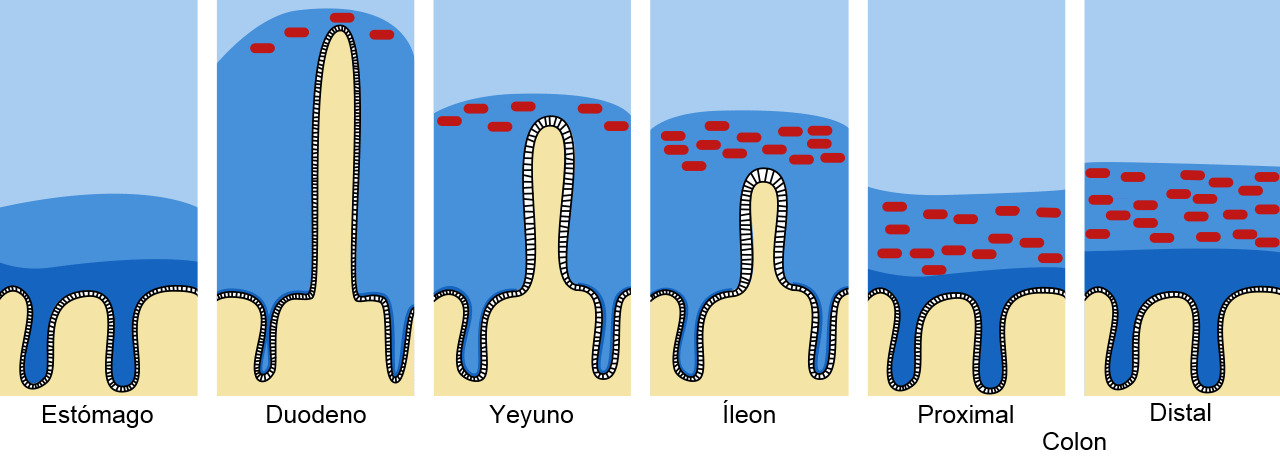
Figura 1. Barrera de moco y mucina en el tracto intestinal. El moco se muestra en azul oscuro y las bacterias en rojo. Adaptado de Pelaseyed T. et al. (2014). Immunological Reviews, 260(1), 8–20.
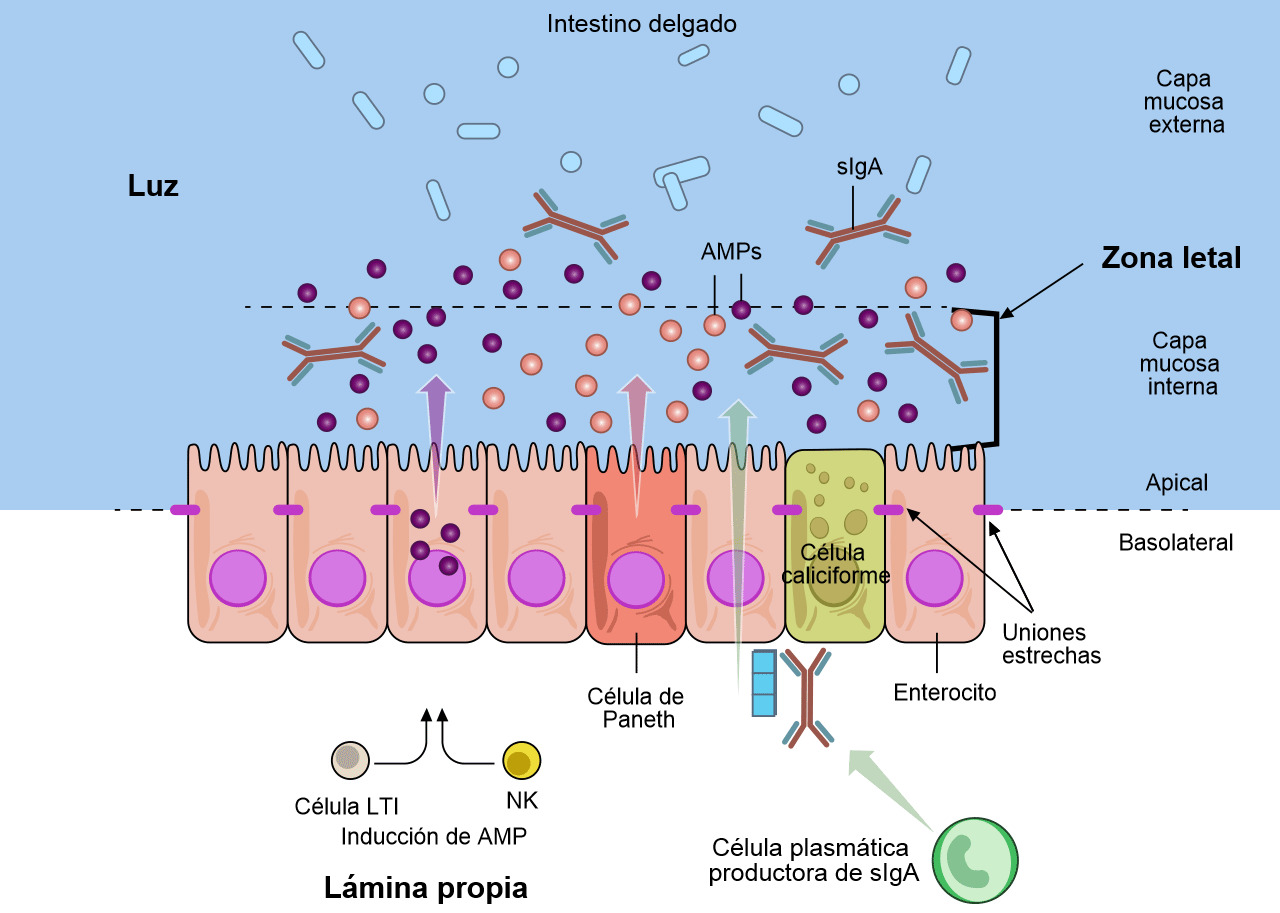
Figura 2. Las defensas de la mucosa del tracto gastrointestinal. Varias subpoblaciones de células epiteliales del intestino (IECs) están integradas en una capa unicelular continua que se divide en una región apical y una basolateral por las uniones estrechas. Los enterocitos y las células especializadas de Paneth detectan la microbiota para inducir la producción de péptidos antimicrobianos (AMPs). Las células caliciformes producen mucina, que se organiza en un gel denso de proteoglicanos muy entrelazado, que forma una capa interna adherente, y una capa externa menos entrelazada. La capa externa está muy colonizada por los constituyentes de la microbiota. La capa mucosa interna está muy impermeabilizada frente a la colonización o penetración bacteriana debido a su gran concentración en AMPs bactericidas, así como a las IgA secretoras específicas (sIgA), que se desplazan desde la superficie basolateral, donde están enlazadas por un receptor a la capa mucosa interna. Como respuesta a la microbiota, las células linfoides innatas, las células inductoras de tejido linfoide (LTi) y las células natural killer (NK), producen citoquinas que estimulan la producción de AMP y mantienen la barrera epitelial. Adaptado de Maynard et al., Nature 489, 231–241 2012
Hay otros componentes de la respuesta inmune que también pueden ser importantes en la protección frente a varios tipos de infección en la superficie mucosa. En el cerdo, los neutrófilos pueden migrar masivamente hacia la luz intestinal como respuesta a complejos antígeno-anticuerpo y matar a los E. coli. La llegada de neutrófilos hacia la luz del intestino y su posterior destrucción conlleva un aumento de la concentración de lactoferrina, lisozima y proteínas catiónicas. Estas substancias también pueden contribuir a la inmunidad frente a infecciones bacterianas del intestino (Maynard et al. 2012).
El destete es un suceso estresante para el lechón. Un destete antes de las 3 semanas conlleva efectos negativos a largo plazo sobre el sistema inmunitario y el desarrollo de la mucosa. El destete temprano a los 17-21 días genera un aumento prolongado de las hormonas del estrés, del factor liberador de corticotropina (CRF) y de los mastocitos, lo que comporta la disfunción de la mucosa intestinal (Chase et al. 2012).
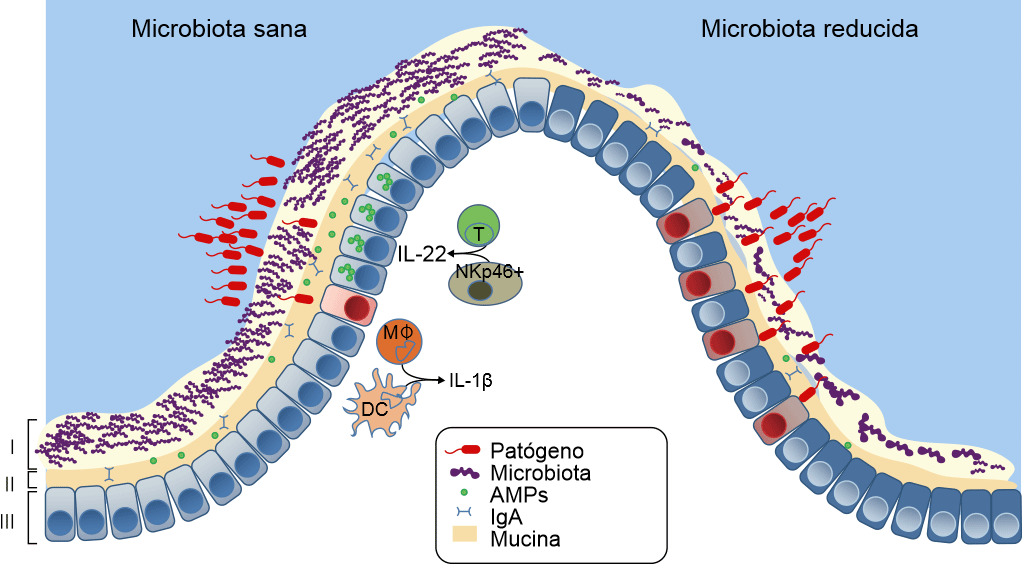
Figura 3. Defensas de una mucosa sana o con disbiosis. La microbiota intestinal proporciona tres niveles de protección frente a la infección entérica. (I) La microbiota satura las zonas de colonización y compite por los nutrientes limitando la asociación de los patógenos con el tejido del hospedador. (II) Zona letal- Los microbios comensales preparan la barrera inmunitaria al inducir la expresión de la mucina, inmunoglobulina A (IgA) y péptidos antimicrobianos (AMPs) que también previenen el contacto de los patógenos con la mucosa del hospedador. (III) Finalmente, la microbiota mejora la respuesta inmune frente a los patógenos invasores. Esto se consigue potenciando la expresión de IL-22 por las células T y las NK, lo que aumenta la resistencia epitelial frente a la infección, así como iniciando la secreción de IL-1b por los monocitos intestinales (MK) y por las células dendríticas (DCs) y esto, a su vez, activa el reclutamiento de células inflamatorias hacia la zona de infección. Si la microbiota está ausente hay menos competencia, menos resistencia de la barrera y menos defensa inmunitaria frente a la invasión de patógenos. Khosravi y Mazmanian, Current Opinion in Microbiology 2013, 16:221–22
El estrés de ser separado de su madre, la edad al destete, la mezcla en un nuevo ambiente y la retirada repentina de la leche materna alteran el ecosistema microbiano intestinal, reducen las defensas ante la entrada de patógenos y aumentan el riesgo de enfermedad, en particular, de la diarrea post-destete (Fouhse et al. 2016). La diarrea post-destete se caracteriza por la reducción de las bacterias comensales, como Lactobacillus spp, y el aumento de los E. coli patógenos (Fouhse et al. 2016). Esto genera una disbiosis —la pérdida de las bacterias buenas con un sobrecrecimiento de los organismos nocivos como E. coli (Fouhse et al. 2016 y Khosravi et al. 2013) (figura 3). Sin embargo, la disbiosis no es sólo la pérdida de la microbiota, también implica la reducción de la "zona letal" —la capa de moco se adelgaza y la cantidad de sIgA y AMP se reduce notablemente, lo que hace que la barrera se debilite, permitiendo que los E. coli enterotoxigénicos entren en contacto con la mucosa y causen enfermedad. Uno de los factores principales que producen disbiosis y diarrea post-destete es la reducción de la ingesta de agua y pienso (Fouhse et al. 2016). La anorexia post-destete y la deshidratación generan cambios estructurales en el intestino, incluyendo atrofia de las vellosidades e hiperplasia de las criptas, lo que también lleva a la disfunción de la barrera intestinal (McLamb et al. 2013). Los destetes tempranos a menos de 20 días de vida comportan un deterioro de la respuesta inmune innata con un número reducido de neutrófilos y citoquinas inflamatorias que son necesarios para controlar las infecciones de E. coli post-destete (McLamb et al. 2013). Para empeorar las cosas, la reducción de bacterias productoras de ácido láctico (Lactobacillus) durante el destete hace que aumente en pH intestinal, aumentando la susceptibilidad a enfermedades ya que el pH bajo es bactericida para E. coli (Fouhse et al. 2016). Las investigaciones destinadas a aumentar los microbios simbióticos y reducir los patógenos oportunistas se centran en la reducción de la disbiosis.
