Patología pulmonar de PRRSV
20-oct-2015 (hace 9 años 5 meses 12 días)
La patogénesis y las lesiones causadas por la infección por PRRSV dependen mucho de las características comunes entre los virus pertenecientes al género Arterivirus: (i) capacidad de entrar y replicarse en sus células diana, los macrófagos; (ii) viremia prolongada tras la infección; (iii) infección persistente de larga duración (no permanente). La fase aguda de la viremia en cerdos de engorde dura unas 4 semanas, después de este periodo el virus se encontrará, predominantemente, en el tejido linfoide – normalmente durante el resto de su vida para un animal de producción – y periódicamente puede reproducirse la viremia (revisado en detalle en Chand et al. 2012, Curr Opin Virol).
Las lesiones inducidas por los virus respiratorios en el tejido pulmonar pueden desarrollarse por dos vías principales: desregulación por destrucción directa de los neumocitos, y/o infección de las células inflamatorias e inmunes que inducen el daño tisular mediante la liberación de citoquinas activas o metabolitos nocivos. Estas células activadas pueden reclutar otras células inflamatorias hacia el sitio de la infección aumentando el daño tisular, aunque también tienen un papel importante en la eliminación viral y la regulación de la inflamación.
Las células diana en las infecciones por PRRSV son los macrófagos alveolares. El daño tisular es la consecuencia de la apoptosis directa (y necrosis) de dichas células y – en mayor medida – sus células vecinas (efecto bystander) debido a la liberación de citoquinas apoptogénicas, especies reactivas del oxígeno y óxido nítrico. Al mismo tiempo se liberan citoquinas proinflamatorias, que son responsables del reclutamiento de otras células inflamatorias y algunas de ellas causan los síntomas sistémicos (fiebre, letargia, etc). También se secretan citoquinas antiinflamatorias y reguladoras. Está bien documentado que, igual que otros virus, PRRSV tiene la habilidad de suprimir la respuesta primaria del interferón tipo I – un potente mecanismo antiviral de la inmunidad innata – en las primeras fases de la infección mediante sus proteínas no estructurales, lo que le permite replicarse y diseminarse de un modo más eficiente. Sin embargo, distintos aislados de PRRSV tienen distintas capacidades inmunomoduladoras por lo que los signos clínicos, las lesiones y el resultado global de la infección depende mucho del peso de los mecanismos que acabamos de describir. El daño/destrucción de los macrófagos puede facilitar la aparición de infecciones secundarias como suele observarse en condiciones de campo.
En las infecciones experimentales llevadas a cabo en granjas aisladas, los signos clínicos y las lesiones observadas dependen mucho de la patogenicidad de la cepa utilizada para inocular a los animales. Las lesiones respiratorias más severas se observan a los 7–14 días PI. Macroscópicamente se trata de áreas consolidadas, oscuras y moteadas que afectan más gravemente a los lóbulos craneoventrales, pero que pueden encontrarse diseminadas en todo el tejido pulmonar (foto 1). Las principales lesiones histopatológicas incluyen: (1) hipertrofia e hiperplasia neumocitarias, (2) infiltración mononuclear septal, (3) restos necróticos intraalveolares, (4) acumulación intraalveolar de células inflamatorias y (5) acumulación perivascular de células inflamatorias.
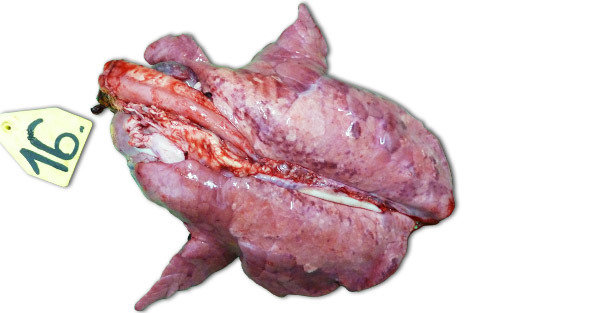
Foto 1. Pulmones de un lechón sacrificado 14 días PI, inoculado con una cepa de alta patogenicidad tipo I subtipo 3 "Lena".
En un estudio con desafío en el que se eutanasiaron los cerdos a los 14 y 21 días PI, en los animales infectados se observó una disminución significativa de los restos necróticos intraalveolares y de células inflamatorias intraalveolares a los 21 días PI; en cambio, sólo se vió un pequeño cambio en las otras tres categorías. Estos hallazgos pueden ser explicados por el hecho de que la formación de restos necróticos intraalveolares y la consiguiente acumulación intraalveolar de células inflamatorias (básicamente granulocitos neutrófilos) reflejan la fase aguda de la enfermedad (foto 2), en la que las substancias nocivas liberadas por los macrófagos infectados causan un gran daño tisular. Tras la fase inicial y aguda – en ausencia de infecciones bacterianas secundarias – el sistema inmune y los mecanismos naturales de curación eliminan el tejido necrótico por lo que las células de la inflamación aguda (granulocitos neutrófilos) desaparecen, los alveolos se vacían y los neumocitos dañados son reemplazados por neumocitos proliferativos tipo II.
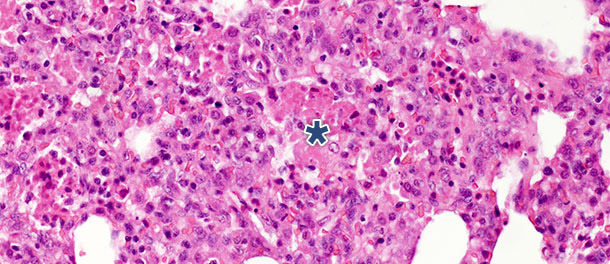
Foto 2. Restos necróticos intraalveolares y acumulación de células inflamatorias (asterisco) en el tejido pulmonar
a los 10 días PI con un aislado de PRRSV tipo 1 subtipo 1. H.E. 200×
Los neumocitos tipo II son células cuboidales que suelen estar localizadas en la inserción de los septos alveolares. En el tejido pulmonar de los mamíferos constituyen el 60% de todas las células alveolares epiteliales, pero sólo cubren alrededor del 5% de la superficie alveolar. Su papel más importante es la síntesis, secreción y reciclado del surfactante pulmonar, que reduce la tensión superficial alveolar, previniendo el colapso durante la espiración. La otra función importante de los neumocitos tipo II radica en su potencial proliferativo. Cuando los neumocitos tipo I son dañados, los tipo II actúan como células progenitoras para reemplazarlos y, con el tiempo, diferenciarse en neumocitos tipo I. En el desafío descrito más arriba, el número de dichas células aumentó significativamente en los 10 días PI (foto 3) y no disminuyó a los 21 días PI. Aunque el estudio se terminó a los 21 días PI y no se observó una curación histológica total (restitutio ad integrum) en el grupo infectado, los animales se recuperaron de la enfermedad clínica y el elevado número de neumocitos tipo II tras la inoculación tanto en las fases iniciales como finales de la enfermedad demuestran su importancia en la curación del tejido pulmonar (se describe con detalle en Balka et al. 2013. J Comp Pathol).
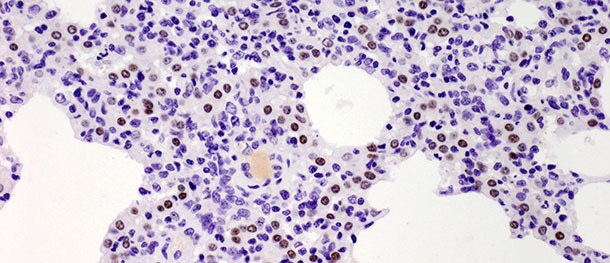
Foto 3. Los puntos marrones indican el núcleo de los neumocitos tipo II identificados con anticuerpos anti-TTF-1. Se observó un aumento significativo en el número de células positivas a los 10 días tras la infección con un aislado tipo I subtipo 1. IHC 200×
