Diagnóstico serológico de PRRS
24-mar-2015 (hace 10 años 9 días)
Métodos para detectar anticuerpos de PRRSV
La inmunofluorescencia indirecta (IFA), la neutralización del virus en suero (SVN), la inmunoperoxidasa en monocapa (IPMA) y la inmunoabsorción ligada a enzimas (ELISA) han sido utilizadas para la detección de anticuerpos específicos frente a PRRSV. Actualmente, IFA, SVN y ELISA se pueden realizar en la mayoría de laboratorios de diagnóstico veterinario de Norteamérica, mientras que en Europa se utiliza mucho IPMA. Todas las pruebas se consideran específicas con diferentes grados de sensibilidad. Generalmente IFA, ELISA y IPMA sirven para detectar anticuerpos totales del isotipo IgG específico para PRRSV, mientras que la SVN se utiliza para detectar anticuerpos funcionales asociados a la inmunidad o protección inmune. IFA y ELISA han sido adaptadas para detectar otros isotipos, como IgM o IgA (Figura 1). Los anticuerpos IgG específicos para PRRSV, que se pueden detectar mediante IFA, IPMA o ELISA, se producen en cerdos infectados entre los días 7 y 14 tras la infección; no obstante, los anticuerpos SVN se pueden detectar incluso de 1 a 2 meses después de la infección (Figura 2). Generalmente los anticuerpos contra PRRSV de infecciones activas se pueden detectar de forma precisa de 3 a 4 meses después de la infección y pueden durar de 6 meses hasta 1 año después del brote.
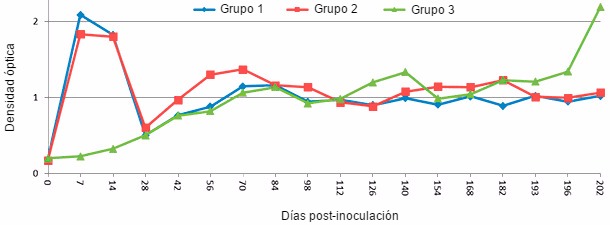
Figura 1. Respuesta de IgM en cerdos jóvenes después de una infección experimental con PRRSV, medida por IDEXX PRRS ELISA 2XR con modificaciones. Los grupos 1 y 2 fueron inoculados con PRRSV tipo 2 por vía intranasal el día 0. El grupo 1 fue reinoculado a los 196 días post-inoculación (dpi), mientras que el grupo 2 no. El grupo 3 no fue inoculado con PRRSV hasta 196 dpi. Los anticuerpos IgM específicos para PRRSV se pueden detectar a partir de 7 dpi y disminuye rápidamente después de 14 dpi. (Nezami S and Yoon KJ, datos no publicados)
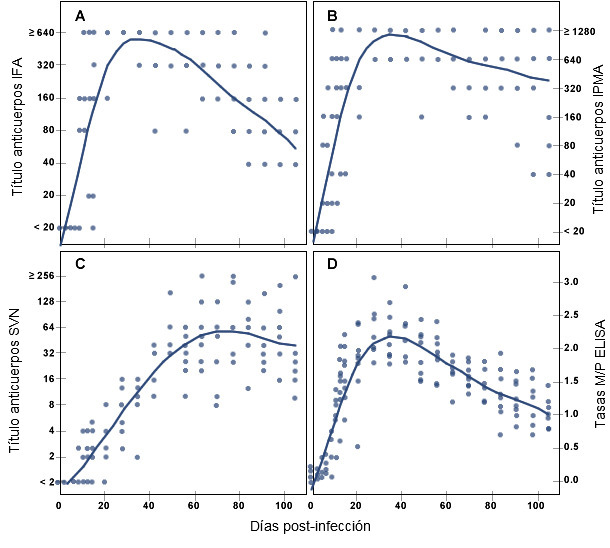
Figura 2. Respuesta de anticuerpos específicos frente a PRRSV durante un periodo de tiempo tras la infección experimental en cerdos, medida mediante la prueba de inmunofluorescencia indirecta (A), ensayo de inmunoperoxidasa en monocapa (B), prueba de neutralización del virus en suero (C) y ensayo de inmunoabsorción ligada a enzimas (D). (Adaptado de la publicación de Yoon K-J, et al.: Characterization of the humoral immune response to PRRSV infection. Journal of Veterinary Diagnostic Investigation, 7:305-312, 1995)
En las pruebas IFA y IPMA se utilizan como antígeno células infectadas por el virus (figura 3). Una ventaja de estas pruebas en comparación con ELISA es que se puede determinar el título de anticuerpos. Sin embargo, los criterios de valoración de los títulos de anticuerpos IFA a menudo varían entre los técnicos y los laboratorios ya que la interpretación es subjetiva. Además, los resultados de la prueba o los criterios de valoración de los títulos de anticuerpos variarán dependiendo del grado en que la cepa de PRRSV utilizada en el ensayo difiera antigénicamente del aislado causante de la infección.
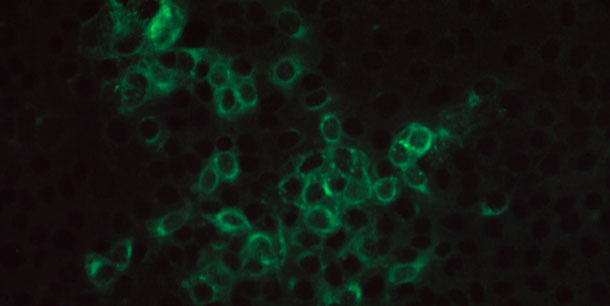
Figura 3. Fotomicroscopía de inmunofluorescencia positiva en una monocapa de células MARC145 infectadas por PRRSV, incubadas con un suero porcino que contiene anticuerpos IgG específicos para PRRSV y teñida con anticuerpos de cabra anti-IgG de cerdo conjugados con FITC.
Se cree que ELISA es más sensible que IFA y IPMA. Se han descrito varios formatos de ELISA: un ELISA indirecto que utiliza un cociente muestra/positivo (M/P), un ELISA indirecto que utiliza valores de DO directos y una ELISA de bloqueo. En la actualidad hay varios kits de ELISA comerciales disponibles para la detección de anticuerpos serológicos específicos para PRRSV (figura 4). La uniformidad en la fabricación del kit y el alto grado de automatización en la realización de la prueba en el laboratorio de diagnóstico dan lugar a una menor variación en los resultados del kit comercial de ELISA en comparación con otros ensayos. Otras ventajas del kit comercial son: a) la detección de anticuerpos contra ambos tipos de PRRSV; b) el tiempo de respuesta rápido; y c) autorización. Últimamente el sistema ELISA también se ha adaptado para el análisis de muestras de fluido oral para detectar anticuerpos de PRRSV como parte de la vigilancia de la granja.
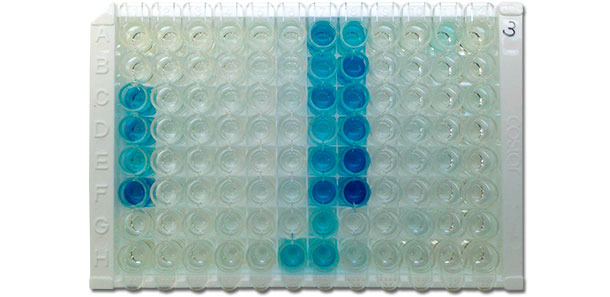
Figura 4. Fotografía de una placa IDEXX ELISA X3 que muestra resultados positivos (color azul) y negativos (sin color). La densidad de color está correlacionada con el nivel de anticuerpos del suero, es decir, cuanto más oscuro es el color, más alto es el título de anticuerpos.
(Foto cortesía de: Dr. David Baum, Iowa State University Veterinary Diagnostic Laboratory)
La prueba SVN también se considera una prueba específica, pero estudios anteriores han sugerido que SVN es menos sensible que IFA y ELISA. La baja sensibilidad de la prueba se debe principalmente al hecho de que los anticuerpos neutralizantes contra PRRSV se desarrollan lentamente y tarde. Al ser una prueba laboriosa, es mejor considerar SVN como una herramienta de investigación y no como una prueba diagnóstica de rutina. Como pasa con IFA y IPMA, los resultados de SVN están muy influenciadas por el grado de relación antigénica entre la cepa usada en la prueba y el aislado causante de la infección.
Interpretación de los resultados serológicos en el diagnóstico de PRRS
La serología es útil para confirmar la presencia (es decir, la seropositividad) y el estado (por ejemplo, altos niveles de anticuerpos en infecciones recientes) de la infección por PRRSV en la granja. La información serológica a partir de una sola muestra no sirve para diagnosticar PRRS clínico en un solo animal ya que la infección por PRRSV tiene una prevalencia muy alta en granjas de cerdos. Al interpretar los resultados serológicos en cerdos jóvenes se debe considerar la posible presencia de anticuerpos maternales. También es importante tener en cuenta que los ensayos serológicos actuales utilizados en el diagnóstico no pueden diferenciar de forma rutinaria entre los anticuerpos inducidos por la vacuna y los anticuerpos inducidos por los aislados de campo. Además, se ha registrado la presencia de posibles falsos positivos de PRRSV incluso con kits comerciales de ELISA. Un resultado serológico negativo a PRRS de las muestras en un momento puntual tiene varias interpretaciones posibles, como: a) Los cerdos no están infectados con el virus; b) Los cerdos se han infectado recientemente con el virus y todavía no han seroconvertido; c) Los cerdos se han infectado con el virus, pero han seronegativizado; y d) El resultado ha sido negativo debido a la baja sensibilidad de la prueba o a un error del laboratorio. Por lo tanto, si se usa una sola muestra puntual, la serología de PRRS se debe utilizar junto con métodos de muestreo de poblaciones válidos para determinar si una granja ha estado expuesta a PRRSV y no para determinar si un animal está infectado.
Para determinar el estado de infección por PRRSV de una granja se suele recomendar el análisis de cerdos jóvenes, en lugar de reproductores. En granjas de ciclo cerrado, en un solo sitio, la seroprevalencia de infección por PRRSV se considera generalmente más alta que en las de engorde-acabado. Normalmente, el suero de 10 cerdos de acabado es suficiente para determinar si la granja ha estado expuesta a PRRSV. Para los sistemas de producción multisitio, cada etapa de producción representa una sola población, por lo que cada sitio debe ser muestreado. La extracción de una serie de muestras de sangre en diferentes etapas de producción es muy útil para determinar la edad en que la infección por PRRSV es más frecuente.
El diagnóstico serológico de la infección por PRRSV, como causante de fallo reproductivo o enfermedad respiratoria, se puede lograr demostrando la seroconversión con un par de muestras de suero o un cambio en el título de anticuerpos (es decir, la elevación del título de anticuerpos) en un par de muestras de suero. No obstante, las cerdas pueden estar expuestas al virus 2 o más semanas antes de la aparición de los signos clínicos, en cuyo caso puede que no se observe el aumento de los títulos de anticuerpos. La presencia de anticuerpos de PRRSV en fluidos fetales o en sangre recogida de lechones nacidos muertos y lechones débiles antes de que ingieran el calostro también es indicativo de infección por PRRSV. Sin embargo, una evaluación diagnóstica definitiva de PRRS respecto a la enfermedad clínica requiere que la información serológica sea interpretada junto con los resultados de otros ensayos víricos.
