Dinámica de la infección por Mycoplasma hyorhinis en explotaciones porcinas comerciales
08-jul-2013 (hace 11 años 8 meses 26 días)
Durante los últimos años ha aumentado el interés por Mycoplasma hyorhinis como causa de poliserositis y artritis en lechones destetados. Si bien se presupone que las cerdas transmiten la bacteria a sus lechones, el conocimiento acerca de su epidemiología y ecología es limitado. En la actualidad hay poca información sobre aspectos esenciales como el momento de la colonización, la dinámica de transmisión post-destete o el papel de la cerda en la propagación de la enfermedad.
En los dos estudios que se presentan a continuación se han utilizado las pruebas de diagnóstico más actuales, como qPCR, y técnicas de recogida, como fluidos orales e hisopos nasales, para ampliar el conocimiento de la epidemiología de este microorganismo en la industria porcina actual.
Estudio 1. Estimación de la prevalencia de la colonización nasal de M. hyorhinis en explotaciones porcinas con poliserositis
Se seleccionaron tres explotaciones de cría de 6000 madres, asignadas como explotación A, B y C, y sus respectivos destetes. Aunque las tres explotaciones tenían antecedentes de enfermedad por M. hyorhinis, sólo las explotaciones A y B presentaron una elevada mortalidad debida a poliserositis en el momento del muestreo. Para cada explotación la toma de muestras consistió en la recogida de hisopos nasales de 60 cerdas y 60 lechones de cada grupo de edad (1, 7, 14 y 21 días de vida), así como 30 cerdos en cada grupo de 28, 35, 42, 49, 56, 63, 70 y 77 días de edad. Además, teniendo en cuenta que M. hyorhinis puede detectarse en la superficie orofaríngea, se tomaron también muestras de fluido oral de un corral por edad en transición. Para investigar el papel de M. hyorhinis en los casos de poliserositis, se tomaron también muestras de tejido de diez animales clínicamente afectados y diez sanos mediante necropsia a la edad en la que se dio el pico de mortalidad en transición. Las muestras se analizaron para M. hyorhinis mediante una qPCR desarrollada en nuestro laboratorio.
Resultados del estudio
Observamos la presencia de M. hyorhinis en la cavidad nasal de 5/60 cerdas la explotación A, en 3/60 en la B y en ninguna de la C. En las explotaciones A y B, donde había presentes casos clínicos de M. hyorhinis, la prevalencia de la colonización fue baja en lechones lactantes (media de 8%) y elevada en post-destete (media de 98%). Por contra, en la explotación C, sin casos clínicos de M. hyorhinis, la colonización fue muy baja hasta la última semana en transición. En relación con los fluidos orales, 7/8 de las muestras recogidas en los cerdos post-destete fueron positivas a M. hyorhinis en las explotaciones A y B, mientras que sólo 1/8 fue positiva en la C. No se observó poliserositis en ninguno de los animales sanos de las tres explotaciones ni en los cerdos enfermos de la explotación C. Sin embargo, en las explotaciones A y B se observó poliserorisitis en 9/10 y 4/10 cerdos enfermos, respectivamente (Figura 1). M. hyorhinis fue detectado por PCR en el pericardio de 8/10 cerdos enfermos en A y 3/10 en B. Se pudo aislar M. hyorhinis del pericardio en las muestras de las explotaciones A y B. En la explotación C, la PCR no detectó M. hyorhinis en ninguno de los cerdos necropsiados.
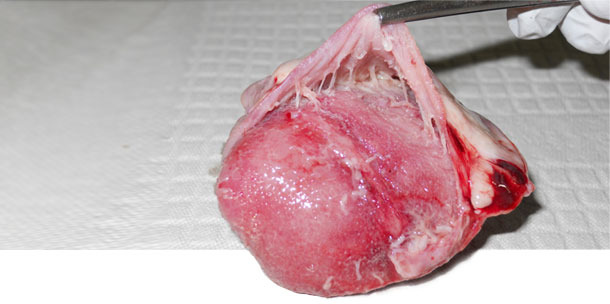
Figura 1. Pericarditis en corazón observada en enfermedad sistémica por M. hyorhinis.
Estudio 2. Estudio longitudinal prospectivo de la colonización por M. hyorhinis en dos explotaciones comerciales
Se seleccionaron dos explotaciones de cría (A y B) con historial de poliserositis y no vacunadas contra M. hyorhinis. En cada explotación se realizó un muestreo longitudinal a distintas edades. Se seleccionaron al azar un total de 50 primerizas de primer y segundo parto y 50 cerdas de tercer parto o más a las que se tomaron hisopos nasales que fueron analizados para detectar M. hyorhinis mediante qPCR y anticuerpos en suero mediante ELISA (Figura 2).
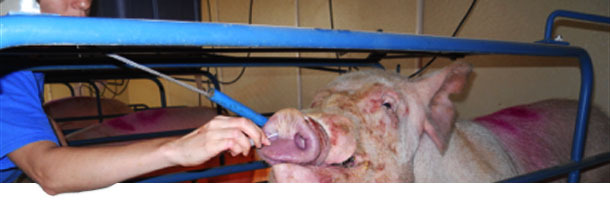
Figura 2. Recogida de hisopos nasales de cerdas para detección de M. hyorhinis mediante qPCR.
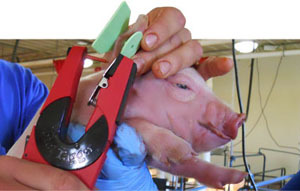
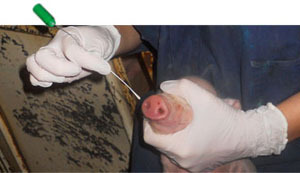
Se seleccionó también al azar un lechón por camada, 100 en total, que fueron crotalados para su identificación. Se tomaron hisopos nasales y muestras de suero de cada lechón en el momento del nacimiento, al destete y a los 10 días post-destete (Figura 3-4). Se realizaron dos nuevas recogidas de muestras en transición y engorde durante los picos de poliserositits/artritis/neumonía. Además, durante el momento de recogida de muestras, y con el objetivo de confirmar el papel de M. hyorhinis en los casos de poliserositis, un total de doce cerdos fueron sacrificados y necropsiados (10 animales clínicamente enfermos y 2 clínicamente sanos). También se recogieron un total de 56 muestras de fluidos orales en post-destete. En resumen, se recogieron un total de 1.050 hisopos nasales de 216 cerdas y 216 cerdos, en 10 momentos de recogida diferentes.
 |
 |
|
Figura 3. Crotalado de lechones antes de la toma de muestras. |
Figura 4. Recogida de hisopos nasales de lechones poco después de nacer. |
Resultados del estudio
M. hyorhinis fue detectado por qPCR en la cavidad nasal de 5/107 cerdas en la explotación A y en 2/110 en la B. Cuatro de las cerdas positivas eran de primer y segundo parto mientras que las otras tres eran de tercer parto. La prevalencia de colonización de los lechones fue baja en ambas explotaciones (media de 1,7%) y alta en el post-destete (media de 85%). La mayoría de los cerdos fueron colonizados poco después de su entrada en transición y permanecieron positivos durante toda la transición y engorde. En ambas explotaciones los resultados de los títulos de anticuerpos mostraron que los lechones tenían anticuerpos (maternos) contra M. hyorhinis poco después del nacimiento. Estos anticuerpos comenzaron a disminuir poco después del destete. Aproximadamente a los 94 y 64 días de vida, en las explotaciones A y B, respectivamente, los títulos de anticuerpos comenzaron a aumentar. Se presupone que este aumento fue debido a una respuesta inmune activa. En la explotación A, 25/31 fluidos orales fueron positivos. Por otra parte, la detección de M. hyorhinis en los fluidos orales fue consistente con la detección en muestras nasales. En la explotación A, M. hyorhinis se detectó en el pericardio (12/18) y en las articulaciones (10/18) de los cerdos enfermos. Del mismo modo, en la explotación B, M. hyorhinis se detectó en el pericardio (5/10) y en las articulaciones (4/10) de los cerdos enfermos. Esto contrastaba con una ausencia de M. hyorhinis en los mismos tejidos de los animales sanos. Todos los cerdos necropsiados fueron PCR positivos para M. hyorhinis en la cavidad nasal.
Consideraciones finales
M. hyorhinis se encuentra de forma habitual en la cavidad nasal de la especie porcina. Sin embargo, no todos los cerdos de una población son colonizados y no todos se colonizan en el mismo momento. Se supone que los pocos lechones colonizados al destete son responsables de la transmisión post-destete.
El uso de fluidos orales para la detección de M. hyorhinis parece ser una herramienta útil en el seguimiento de la dinámica de infección en una explotación y permite una mejor temporización del tratamiento con antibióticos o vacunas. Sin embargo, se requiere una validación adicional para la detección de M. hyorhinis en los fluidos orales.
El conocimiento de la dinámica de infección en las explotaciones permitirá implementar mejores estrategias de control en las explotaciones afectadas.
