Caso clínico: Epidermitis exudativa por Staphylococcus hyicus y Staphylococcus chromogenes
05-jul-2013 (hace 11 años 8 meses 28 días)
Introducción
La epidermitis exudativa (EE), o síndrome del cerdo graso, es una patología cutánea de origen bacteriano que puede producirse en cualquier edad, aunque es más frecuente en lechones lactantes y recién destetados. Ha sido descrita en la mayoría de países donde se crían cerdos y termina ocurriendo en la mayoría de las explotaciones. Staphylococcus hyicus, la bacteria causante de la EE, puede recuperarse de la nariz, ojos y piel de cerdos sanos y de la vagina de cerdas también sanas. Este organismo puede persistir durante varias semanas en el ambiente de la granja.
Esta patología es más dramática en animales nacidos de cerdas no inmunes. Los traumatismos cutáneos producidos por peleas, corte de dientes o suelos o camas abrasivas pueden traspasar las capas protectoras de la piel. Las lesiones de la EE están asociadas a las toxinas exfoliativas termolábiles producidas por S. hyicus. Los cambios en la piel están acompañados por un aumento de la secreción sebácea y un exudado seroso. La mortalidad asociada a la EE está básicamente relacionada con la deshidratación, aunque también pueden producirse septicemia y artritis.
Antecedentes
Este caso en concreto sucedió en una explotación de ciclo cerrado multisitio en el sureste de Ontario, Canadá. Durante el tiempo que duró este caso no se apreciaron signos clínicos significativos de EE en las cerdas. Esto incluye ausencia de signos clínicos en las cerditas de reposición que estaban alojadas en unas naves de transición y cebo situadas en el mismo sitio 1. El brote empezó en una de las dos transiciones externas (sitio 2) de flujo continuo que se utilizaban. Varios meses después aumentaron también los casos en la segunda transición.
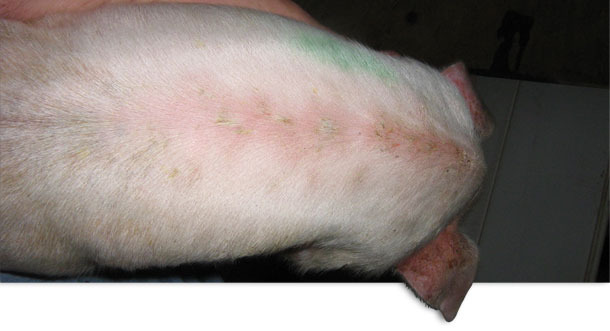
Foto 1. EE localizada aguda.
Los lechones se destetaban una vez por semana a las tres semanas de vida. Originalmente no aparecían signos clínicos hasta, aproximadamente, los 10-14 días postdestete. Una observación más detallada reveló que, durante los primeros días tras el destete, los lechones desarrollaban lesiones localizadas en los cortes y rascadas asociadas a las peleas. En esta granja no se practicaba el descolmillado. Algunos lechones sólo mostraban lesiones localizadas (foto 1), aunque en otros se observaban signos clínicos de letargia y un rápido desarrollo de un color rojizo en la piel, que se notaba caliente al tacto. En las axilas, ingles, vientre y detrás de las orejas aparecían escamas finas y marrones. Este exudado se extendía por toda la superficie de la piel (foto 2). En unos pocos días, la piel se oscurecía y adquiría una textura grasienta. Los lechones muy afectados perdían peso muy rápidamente y solían morir a los pocos días. No había picor aparente. La reducción del crecimiento fue notable en algunos de los supervivientes y los retrasados crónicos se terminaron eutanasiando. La mortalidad postdestete, que solía ser del 2,0 %, aumentó hasta el 4,0 % y, en algunos corrales concretos, hasta el 9 %. Este problema persistió durante unos 13 meses. Casi todo el aumento de mortalidad era atribuible a la EE.
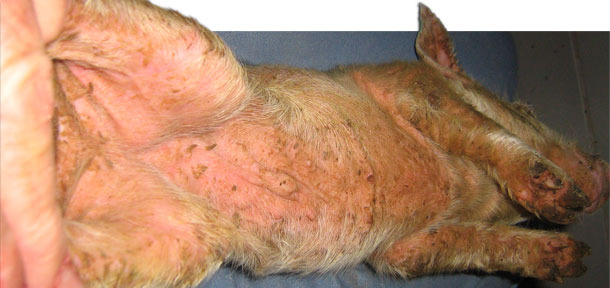
Foto 2. EE generalizada aguda.
Diagnóstico
Inicialmente se aisló S. hyicus en grandes cantidades a partir de hisopos de los animales afectados. En hisopos posteriores se identificó Staphylococcus chromogenes. Este microorganismo es genéticamente muy similar a S. hyicus y también puede producir toxinas exfoliativas. El antibiograma indicó que era resistente a la penicilina pero sensible a trimetoprim/sulfa y a la tiamulina. El hallazgo de la resistencia a la penicilina era consistente con investigaciones recientes que documentaban que la resistencia de S. hyicus a la penicilina era frecuente en Ontario (figura 1). Un análisis más detallado en la Universidad de Guelph encontró que este aislado en particular también era resistente al zinc. Se llevaron a cabo diagnósticos y necropsias adicionales para descartar la presencia de enfermedades subyacentes que exacerbaran el problema, pero no se pudo identificar ninguna.
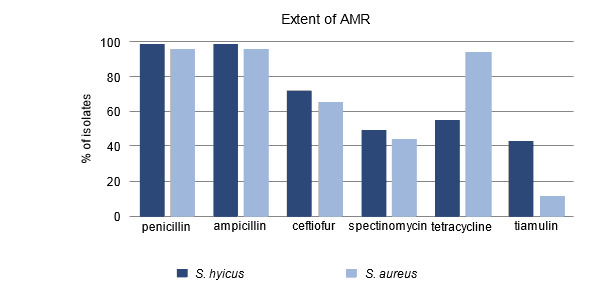
Figura 1. Porcentaje de aislados resistentes a antimicrobianos.
Intervención
La EE es una enfermedad típicamente multifactorial. Pese a que identificar y corregir un sólo factor puede ser suficiente a veces, en este caso teníamos que mejorar tanto la inmunidad maternal como la barrera inmune local que proporciona una piel intacta. También era importante reducir la carga bacteriana.
Al revisar la formulación y la cantidad de pienso por cerdo, no se observó ningún problema, aunque se observó que debía hacerse alguna mejora en la cantidad de pienso ofrecida por cerdo en algunas fases específicas del crecimiento. El pienso se mantenía fresco y palatable y se utilizaba toda la superficie disponible de comedero para evitar peleas para acceder al pienso. Al identificarse la resistencia al zinc, se retiró el complejo de zinc del pienso.
El protocolo normal en estas transiciones incluía quitar las puertas frontales de los corrales para posibilitar el contacto y la colonización temprana de los lechones con tantos microbios como fuera posible. Estos microbios incluían Streptococcus suis, Haemophilus parasuis y Actinobacillus suis. En este caso se decidió cerrar dichas puertas para tratar de frenar la diseminación de la EE. Los corrales se mantuvieron cerrados durante las primeras 4 semanas postdestete y luego se abrían para formar grupos más grandes: a esa edad ya había muy pocos nuevos casos de EE.
Hubo un gran debate sobre el papel de los dientes de los lechones en los cortes y rascadas producidos en las peleas. Los operarios del destete abogaban por el descolmillado si con esto iba a solucionarse el problema. Se probó en varios lotes de cerdos y todo el mundo estuvo de acuerdo que, al menos en este caso, el corte de dientes no redujo la incidencia ni la severidad de la EE, por lo que dejó de hacerse de nuevo.
Se evaluó el suministro de agua. Algunos bebederos no funcionaban adecuadamente, por lo que se repararon y prepararon para garantizar un caudal mínimo de 0,5 litros/minuto. El objetivo fue evitar salpicaduras que pudiesen humedecer la piel y asegurar un caudal y número de bebederos suficientes para minimizar las agresiones por competencia.
El objetivo de humedad relativa era del 70% para el otoño, invierno y primavera y se utilizaba calefacción adicional para poder mantener una ventilación mínima. Cuando los lechones entraban, las salas se calentaban hasta los 28ºC. Se verificó el aislamiento del techo. Los lechones se mantenían secos y sin corrientes de aire.
Las salas se llenaban con una densidad inicial un 10 % superior a la objetiva, para poder dejar un corral libre como hospital donde mover rápidamente a los primeros casos: los lechones con la piel roja e inflamada se trasladaban al corral hospital para evitar la diseminación. Al vaciar la sala, los lechones recuperados se transferían al engorde y no se mezclaban con los lechones más jóvenes.
También se revisó la limpieza: tras el vaciado de las salas éstas se remojaban inmediatamente y, al día siguiente, se procedía al lavado. A raíz del brote, se prestó más atención al lavado. Se utilizaba un limpiador alcalino para el desengrasado y la eliminación del biofilm y un limpiador ácido para eliminar ciertos minerales. Se calibraron los dosificadores de desinfectantes y se probaron varios desinfectantes, aunque ninguno demostró ser mejor que los otros. Se dejaba un periodo de secado de un mínimo de 24 h antes del nuevo llenado.
Los lechones afectados se inyectaban con trimetoprim/sulfa a las dosis recomendadas por el fabricante durante 4 días. Durante los primeros 21 días de estancia en la transición se medicaba preventivamente en agua con trimetoprim/sulfa. Posteriormente se cambió a un tratamiento intermitente, con 3 días de medicación y 4 sin, durante las primeras 3 semanas en la transición. Finalmente el tratamiento pasó a administrarse sólo en casos necesarios.
El pienso starter estaba medicado con clortetraciclina a 110 ppm, sulfametacina a 110 ppm y procaína penicilina a 55 ppm. El pienso de transición estaba medicado con procaína penicilina a 110 ppm. No se utilizaron otros tratamientos.
Se utilizaba un spray tópico a base de trimetoprim/sulfa y aceite mineral que se usaba preventivamente cada 4 días. Además el spray se aplicaba a los primeros signos de un aumento de casos nuevos. En una sala de 500, cuando se detectaban 3 nuevos casos por la mañana y 3 por la tarde, se rociaban todos los animales.
Antes del brote se había añadido un aislado de S. hyicus a la autovacuna específica para la granja que se administraba preparto. Esta vacuna personalizada se preparaba utilizando bacterias aisladas de cada flujo concreto de cerdas, lechones de transición y cerdos de engorde. Al vacunar a las cerdas antes del parto se mejoraba la inmunidad pasiva calostral. Por lo tanto los aislados de S. hyicus y S. chromogenes de transición se añadieron a la vacuna autógena administrada antes del parto. No se observó una mejora inmediata cuando los lechones de las cerdas inmunizadas llegaron a la transición. La autovacuna preparto todavía se sigue utilizando. Las nulíparas son vacunadas dos veces antes del parto y las cerdas reciben una dosis de recuerdo antes del siguiente parto.
Discusión
El rendimiento en la transición ha recuperado los valores normales, pero con un considerable aumento en las prácticas de manejo requeridas anteriormente a la aparición del caso para mantener la enfermedad bajo control. Al principio, los signos clínicos más graves se redujeron a una de las dos transiciones y parece que los movimientos de lechones y personas podrían explicar la afectación de la segunda. Nunca hubo ninguna evidencia de que las cerdas hubieran tenido contacto con los aislados más "problemáticos". Esta ausencia de aislados en la población de cerdas explicaría por qué la inmunidad maternal habría sido de poca ayuda para controlar la enfermedad en la transición. En teoría una despoblación y repoblación completa en el flujo contínuo de las transiciones podría eliminar los aislados más problemáticos. Puede argumentarse que el problema se prolongó debido a la "ausencia" de la bacteria problema en las cerdas.
