Clostridiosis
24-jul-2009 (hace 15 años 8 meses 10 días)
Introducción
El género Clostridium comprende numerosas especies de bacterias con forma de bacilos grandes, anaerobias, formadoras de esporos y productoras de toxinas extremadamente potentes y de muy diversas características que son, casi siempre, las responsables finales de las enfermedades que causan. Por ello, las vacunas contra las enfermedades causadas por clostridios deben contener las toxinas atenuadas contra las que se desea proteger. Afortunadamente, la mayor parte de estas toxinas son proteínas con alto peso molecular y, por tanto, muy inmunógenas e inducen títulos elevados de anticuerpos.
Se pueden encontrar distintas especies de clostridios formando parte de la microbiota del intestino grueso de los cerdos sanos. Aunque bastantes de estas especies son patógenas, en condiciones normales no proliferan lo suficiente como para causar ningún tipo de enfermedad.
El cerdo puede padecer enfermedades causadas por especies muy diversas de clostridios, pero en las diarreas que padecen los lechones en las primeras semanas de vida participan principalmente los siguientes:
| Especie | Enfermedad |
|
Cl. perfingens tipo C |
Enteritis hemorrágica del recién nacido |
|
Cl. perfringens tipo A |
Enteritis necrótica |
| Cl. difficile | Tiflocolitis neonatal |
Enteritis hemorrágica del recién nacido
Etiología y patogenia
La enteritis hemorrágica del recién nacido aparece, como su propio nombre indica, en los primeros días de vida debido a la especial patogenia de esta enfermedad.
El agente causal, Clostridium perfingens tipo C produce fundamentalmente una toxina, denominada toxina β y también toxina ε. Ambas tienen la particularidad de ser sensibles a la tripsina. Por ello, sólo afecta a los lechones recién nacidos que están tomando calostro debido a que el calostro contiene inhibidores de la tripsina, lo que permite a la toxina mantenerse activa en el intestino delgado de estos lechones. En animales de mayor edad, las toxinas β y ε sólo mantienen su actividad raramente cuando la dieta contiene inhibidores de la tripsina o en animales que tengan algún tipo de deficiencia pancreática.
Epidemiología y patogenia
En condiciones normales, la fuente de infección principal de los lechones son las heces de las cerdas que contienen esporos de Cl. perfringens por formar éste parte de su flora digestiva.
No obstante, no debe olvidarse que una de las características que comparten todos los clostridios es la capacidad de formar esporos con una enorme resistencia a las condiciones ambientales. Por ello, las parideras insuficientemente desinfectadas pueden mantener la cantidad de esporos suficiente como para infectar a los lechones recién nacidos.
La infección la favorecen la suciedad de la paridera y especialmente la suciedad de la ubre de las cerdas, que pueden favorecer que el lechón se infecte con grandes cantidades de esporos al mamar. La falta de una flora digestiva totalmente desarrollada en el lechón facilita la multiplicación masiva de Cl. perfringens en el intestino. No obstante, la enfermedad también aparece en parideras modernas en las que no hay un grado de suciedad apreciable.
Este clostridio tiene un tiempo de generación muy corto y, en condiciones adecuadas, puede alcanzar en unas horas en el intestino concentraciones de 100 a 1.000 millones de bacterias por gramo que se adhieren a los enterocitos de los ápices de las vellosidades, sobre todo en el yeyuno, provocando descamación de los enterocitos y necrosis de la lámina propia de las vellosidades que origina hemorragias. La necrosis puede alcanzar las criptas, la capa muscular de la mucosa y la submucosa y, a veces, penetra hasta la capa muscular de la pared intestinal.
Además, el enorme número de bacterias genera una gran cantidad de toxina β, que es letal, necrotizante e inflamatoria y aumenta la permeabilidad de los capilares.
La muerte se debe a las lesiones intestinales y a la toxemia que origina la enfermedad.
Cuadro clínico y lesional
El cuadro aparece habitualmente en los tres primeros días de vida y suele afectar a camadas aisladas a menos que las condiciones higiénicas sean muy deficientes, aunque a veces sobre todo en granjas nuevas en las que las cerdas no están vacunadas hay brotes epizoóticos que pasan a enzoóticos una vez que las cerdas adquieren inmunidad suficiente tras su exposición a los lechones infectados.
El cuadro clínico se caracteriza porque en algunos casos hay muertes hiperagudas sin signos clínicos previos, si bien habitualmente se observa una diarrea claramente hemorrágica que mancha la zona perineal.
Los lechones están muy débiles, tienden a no moverse y pueden ser aplastados con facilidad. La mortalidad es prácticamente del 100 % de los lechones afectados en un plazo de tiempo que no suele ser mayor de 1-2 días. Antes de la muerte, se observa a veces un ennegrecimiento de la piel del abdomen.
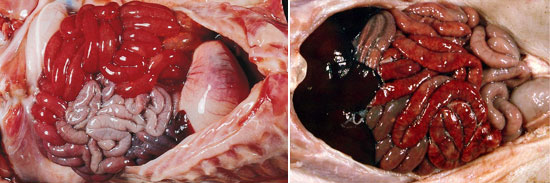
Cl. perfringens tipo C: enteritis hemorrágica (Autores: Librado Carrasco y Quim Segalés)
El cuadro lesional es muy llamativo. Hay edema de la pared del abdomen y líquido sanguinolento en la cavidad abdominal. Al observar el intestino se aprecia una intensa enteritis hemorrágica que afecta a todo el intestino delgado, principalmente al yeyuno y al íleon.
En la pared intestinal hay hemorragias intensas y burbujas de gas y la mucosa tiene una enteritis hemorrágica que ocupa grandes áreas de la superficie o toda ella.
En lechones hijos de cerdas con un cierto grado de inmunidad puede aparecer una forma subaguda de la enfermedad sin diarrea hemorrágica. En este caso, las heces son amarillentas y contienen restos necróticos. Los lechones mantienen el apetito y la vivacidad, pero pierden peso progresivamente y la mayoría de ellos mueren a los 5-7 días de edad. Estos lechones tienen la pared intestinal engrosada y friable y la mucosa está cubierta de una membrana necrótica muy adherida.
En algunos casos, se manifiesta una forma crónica. Los lechones afectados pierden peso progresivamente y tienen una diarrea intermitente con heces mucosas amarillentas o grisáceas que manchan el periné. Las lesiones son similares a las de la forma subaguda, pero más localizadas.
Diagnóstico
El diagnóstico de la enteritis por Cl. perfringens tipo C es sencillo en la forma aguda. La edad de los lechones afectados y el cuadro clínico y lesional son muy orientativos. En la forma subaguda y crónica puede ser más complejo y suele ser necesario diferenciarlo de otras causas de enteritis necrótica, principalmente de la causada por Cl. perfringens tipo A, mediante el aislamiento e identificación en el laboratorio.
Tratamiento y profilaxis
El tratamiento en la enteritis causadas por Cl. perfingens tipo C es muy poco eficaz. En la forma aguda, la mortalidad es tan rápida que no da tiempo a instaurar el tratamiento y en la forma subaguda y crónica, las lesiones de la mucosa intestinal son difícilmente recuperables.
Por ello, es mucho más importante la profilaxis. La higiene de las parideras y el lavado de la ubre de las cerdas contribuyen a dificultar la infección de los lechones y pueden darse tratamientos preventivos a las cerdas lactantes con ampicilina o amoxicilina para prevenir la infección de los lechones.
También se pueden emplear estos antibióticos y las cefalosporinas de forma preventiva administrándoselos por vía oral a los lechones durante los tres primeros días de vida.
No obstante, la medida de profilaxis más importante y con mejor relación coste/beneficio es la vacunación de las cerdas con toxoides. Como indicábamos, las toxinas clostridiales son proteínas de alto peso molecular y, por tanto, buenos inmunógenos y la vacunación de las madres induce anticuerpos que se transfieren a los lechones por el calostro y les dan una protección muy elevada.
Enteritis necrótica
La enteritis necrótica afecta tanto a los lechones lactantes como a lechones destetados.
Etiología y patogenia
Cl perfringens tipo A forma también parte de la flora intestinal de los cerdos sanos y, por ello, las heces de las cerdas son la principal fuente de infección para los lechones.
La patogenia de esta enfermedad no se conoce con exactitud. Cl perfringens tipo A produce la toxina α, que es una lecitinasa hemolítica y recientemente se ha encontrado otra toxina denominada β2 que está presente en la mayoría de las cepas aisladas de lechones enfermos y que parece tener un papel fundamental en el desarrollo de la enfermedad.
La infección, en las condiciones adecuadas, provoca una multiplicación masiva de este clostridio en el íleon, el ciego y el colon sin que haya ni adhesión al epitelio intestinal ni invasión del mismo.
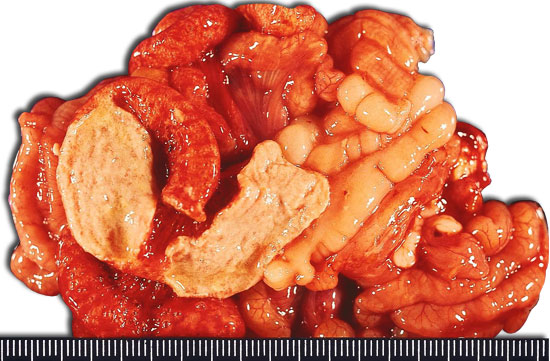
Cuadro clínico y lesional
Cl perfringens tipo A causa una diarrea de tipo secretor y hay lesiones leves de atrofia de las vellosidades, necrosis, inflamación de la mucosa y salida de fluidos a la luz intestinal. La toxina α provoca edemas de las vellosidades intestinales y aún no está claro el papel de la toxina β2, aunque se detecta en más del 90 % de las cepas patógenas.
El cuadro clínico puede manifestarse ya en los primeros días de vida en lechones hijos de cerdas sin inmunidad suficiente. Otras veces se retrasa hasta el final de la lactación o incluso a después del destete cuando baja la inmunidad materna.
Los lechones tienen mal aspecto, con el pelo largo y los flancos hundidos y una diarrea pastosa amarillenta o grisácea que mancha el periné y que dura unos cuantos días. En ocasiones, las heces contienen mucus y algunas manchas de sangre o un color rosáceo. La mortalidad es baja, pero los animales manifiestan un retraso considerable que se mantiene mucho tiempo y a veces no se recupera del todo.
Tratamiento y profilaxis
El tratamiento debe ser lo más rápido posible. Se han utilizado tradicionalmente las penicilinas y derivados. Actualmente las cefalosporinas tienen una gran eficacia.
La profilaxis es más rentable que el tratamiento. La vacunación de las cerdas con una vacuna adecuada es la mejor medida de profilaxis ya que transfieren una buena inmunidad a los lechones lactantes.
Tiflocolitis neonatal
Etiología y patogenia
Clostridium difficile es una importante causa de diarrea asociada al uso de antibióticos en el hombre y cada vez se describe con mayor frecuencia como una de las causas de enteritis en lechones recién nacidos.
Cl. difficile es un anaerobio estricto, lo que dificulta su aislamiento y produce dos toxinas denominadas A y B. La toxina A es una enterotoxina de elevado peso y la B es una citotoxina muy potente.
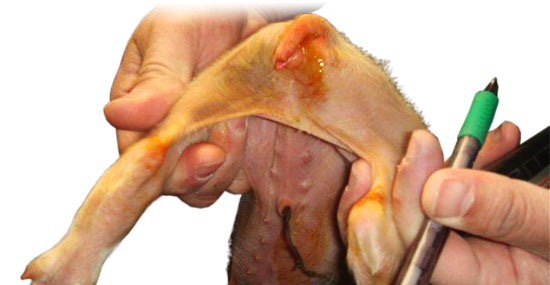
Diarrea por Cl. difficile (Autor: Jesús Bollo)
Cuadro clínico y lesional
La enfermedad aparece principalmente en la primera semana de vida tanto en lechones que han recibido tratamiento antibiótico como en los no tratados. En las camadas afectadas, enferman la mayor parte de los lechones con una mortalidad que puede llegar al 50 %. El cuadro clínico se caracteriza por diarrea que aparece en los primeros días de vida, disnea y distensión abdominal con edema del escroto.
En la necropsia hay hidrotórax y ascitis, edema del mesocolon y de la serosa del colon y el contenido del colon es acuoso o pastoso y tiene un color amarillento.
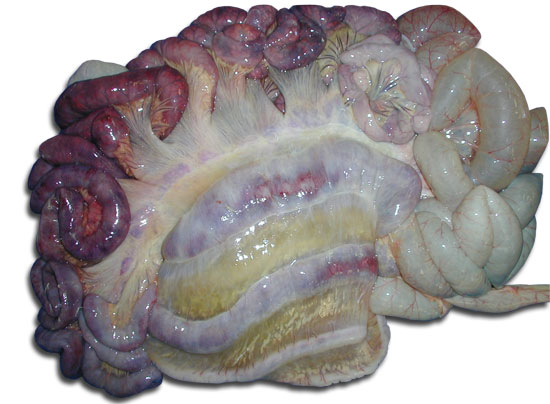
Cl. difficile edema del mesocolon y de la serosa del colon (Autor: Librado Carrasco)
Diagnóstico, tratamiento y profilaxis
El diagnóstico se basa en la detección de las toxinas A y B en las heces o en el contenido del colon de los lechones.
Se han empleado la tilosina y la virginiamicina en el pienso de las cerdas lactantes como profilácticos. Para el tratamiento de los lechones afectados se emplean las penicilinas, la tilosina, la tilmicosina, las tetraciclinas y la eritromicina y las cefalosporinas.
No hay vacunas disponibles en este momento contra Cl. difficile, pero la experiencia de la enfermedad en otras especies indican que la inmunidad contra las toxinas confiere protección.
Experimentalmente se ha demostrado que la administración de esporos de cepas apatógenas de Cl. difficile bien directamente por vía oral a los lechones o indirectamente impregnando la ubre de las cerdas protege contra la enfermedad que causan las cepas patógenas por una exclusión competitiva.
