Proteína bruta en la dieta de lechones
24-oct-2008 (hace 16 años 5 meses 17 días)
Según las normas FEDNA se recomiendan niveles de proteína para lechones de entre 19,5-22% y 19-21% para lechones de entre 5 a 7kg y 7 a 12kg, respectivamente. Asimismo expone que en casos de diarrea o en granjas con sanidad o manejo deficientes es conveniente reducir el contenido de proteína de la dieta en una unidad porcentual, pero evitando niveles inferiores al 17% de proteína bruta (pueden ser limitantes en Ile o Val).
Al reducir el nivel de proteína del pienso de lechones se deberían tener en cuenta los siguientes aspectos:
|
También hay que valorar el tipo de fuente de proteína utilizado en aspectos tales como:
|
En condiciones normales suelen obtenerse mejores resultados productivos con dietas de calidad y altamente nutritivas, pero en situaciones más comprometidas puede ser más adecuado usar dietas más robustas intestinalmente a pesar de poder ver reducidas ligeramente las producciones. De todas maneras, siempre será más favorable un escenario sin patología digestiva.
Estructura de la proteína
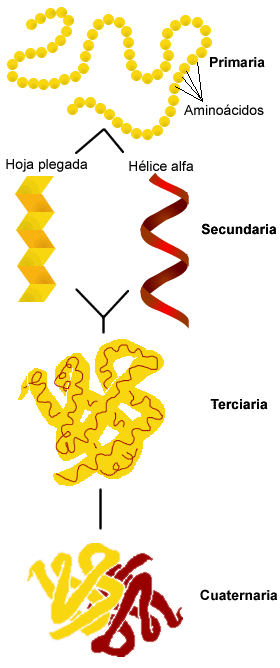 |
Primaria: determinada por la secuencia de aminoácidos. |
|
Secundaria: plegamiento de la cadena polipeptídica por la formación de enlaces de hidrógeno, mayoritariamente entre los grupos amina y carboxilo de la cadena principal. Las estructuras más frecuentes son la hélice alfa y la lámina beta (ó hoja plegada). En el cuadro adjunto se describen con más detalle las diferentes estructuras. |
|
|
Terciaria: plegamiento tridimensional de las proteínas establecida por enlaces covalentes y puentes de hidrógeno. |
|
|
Cuaternaria: ensamblaje de varias estructuras polipeptídicas.
|
Las nuevas técnicas analíticas nos permiten conocer con mayor detalle la estructura interna de las proteínas, pudiendo relacionarla con su valor nutritivo. Es posible estudiar las diferencias en la composición y estructura de la proteína de las distintas plantas y variedades, así como evaluar las modificaciones de la estructura interna de las proteínas debidas a diferentes tipos y condiciones de procesado.
|
Principales tipos de plegamientos de la estructura secundaria de las proteínas
|
|
Hélice alfa: enrollamiento en espiral sobre sí misma debido a los giros producidos en torno al carbono alfa de cada aminoácido. Esta estructura se mantiene gracias a los enlaces de hidrógeno intracatenarios formados entre el grupo -NH de un enlace peptídico y el grupo -C=O del cuarto aminoácido que le sigue.
|
|
Láminas beta o hoja plegada: algunas regiones de las proteínas adoptan una estructura en zig-zag y se asocian entre sí estableciendo uniones mediante enlaces de hidrógeno intercatenarios. Todos los enlaces peptídicos participan en estos enlaces cruzados, confiriendo así gran estabilidad a la estructura. La forma en beta es una conformación simple formada por dos o más cadenas polipeptídicas paralelas (que corren en el mismo sentido) o antíparalelas (que corren en direcciones opuestas) y se adosan estrechamente por medio de puentes de hidrógeno y diversos arreglos entre los radicales libres de los aminoácidos. Esta conformación tiene una estructura laminar y plegada, a la manera de un acordeón.
|
|
Hoja beta: Cuando la cadena principal se estira al nivel máximo que permiten sus enlaces covalentes se adopta una configuración espacial denominada estructura beta.
|
|
Giros beta: Secuencias de la cadena polipeptídica con estructura alfa o beta, a menudo están conectadas entre sí por medio de los llamados giros beta. Son secuencias cortas, con una conformación característica que impone un brusco giro de 180 grados a la cadena principal de un polipéptido.
|
|
Hélice de colágeno: Es una variedad particular de la estructura secundaria, característica del colágeno, proteína presente en tendones y tejido conectivo; es una estructura particularmente rígida.
|
|
Enrollamiento al azar: plegamiento aleatorio sin estructura definida.
|
