Estado metabólico y homeostasis mineral en infecciones por S. suis. ¿Qué sabemos?
28-jun-2023 (hace 1 años 9 meses 1 días)
Streptococcus suis (S. suis) es un patógeno endémico y zoonótico que no dispone de pautas adecuadas de prevención para los lechones de destete que no sean los antibióticos. La patogénesis se asocia principalmente a la colonización del tracto respiratorio superior y las tonsilas como vía de entrada al sistema circulatorio (Segura et al., 2016), aunque no se descarta la infección gastrointestinal (Swildens, 2009). La colonización se produce al nacer, durante la fase de destete cuando los lechones se mezclan y durante los brotes. Con frecuencia, los brotes se asocian a coinfecciones y factores de estrés identificados como posibles desencadenantes, pero el proceso natural de la infección no es completamente conocido y carecemos de un modelo experimental repetible que imite los primeros pasos de la enfermedad. La enfermedad es reconocida por presentar signos clínicos neurológicos asociados a meningitis con deterioro de la movilidad y frecuentemente mortalidad.
Se conoce por modelos humanos y animales que la respuesta inflamatoria en las meninges se caracteriza por una reducción del contenido de glucosa y un aumento del lactato en el líquido cefalorraquídeo (LCR). La presencia de inflamación en la barrera hematoencefálica (BHE) y en la barrera sangre-líquido cefalorraquídeo (sangre-LCR) compromete sistémicamente la función cerebral, el intercambio iónico y la homeostasis de minerales (Bettinelli et al., 2012). En este contexto, desconocemos cuál sería la condición en lechones afectados de forma natural. Esta información podría ayudar a identificar factores de susceptibilidad y definir estrategias de soporte a la salud y la recuperación del lechón enfermo.
El objetivo de esta investigación fue estudiar varios brotes sospechosos de S. suis, en nuestro centro de investigación porcina incluyendo los sub-objetivos:
- Diagnosticar los brotes
- Evaluar el impacto relativo de la enfermedad,
- Proporcionar nuevos conocimientos sobre la fisiopatología de la enfermedad.
Nuestra granja de investigación incluye ~160 cerdas productivas organizadas en lotes cada 4-5 semanas, produciendo alrededor de 560 cerdos por lote con aproximadamente 24 días de edad al destete. Se llevan a cabo investigaciones sobre alimentación y estudios de manejo de forma constante y simultánea en varias áreas que incluyen cerdas gestantes, cerdas lactantes, lechones y lechones destetados (alojados en corrales convencionales con n = 3-6 cerdos/corral o sistemas de alimentación electrónica con n = 10-12 cerdos/corral; slats totalmente de PVC).
Cuando se observaron signos clínicos compatibles con la enfermedad estreptocócica, se recogieron muestras de sangre e hisopos de tonsilas de 2 cerdos por corral (uno de cerdo enfermo y otro cerdo seleccionado al azar). Posteriormente, los cerdos enfermos fueron medicados con ampicilina y dexametasona durante 3 días. Los casos con disfunción del sistema nervioso central se asociaron a meningitis y se definieron como enfermos graves (incluían pérdida de equilibrio, ataxia, parálisis, opistótonos, temblor generalizado y pedaleo). Otros casos con signos distintos de los neurológicos incluían abatimiento, enrojecimiento de la piel y cojera, probablemente asociados a septicemia y artritis. Los compañeros de corral seleccionados al azar se consideraron control. Se tomaron muestras de sangre dentro de los 5 minutos siguientes a la detección de los signos clínicos. La sangre y el suero se analizaron en busca de gases y minerales. Los hisopos de tonsilas se analizaron mediante qPCR para los serotipos 2 (y/o 1/2), 7 y 9 de S. suis. Se pesaron los lechones en el momento del muestreo, se repitió a los 7 días y se buscaron datos retrospectivos en los registros de nuestra granja.
El estudio incluyó tres brotes principales en los lotes de invierno (3.8% de incidencia), primavera (5.3% de incidencia) y otoño (9% de incidencia). Cada brote fue diagnosticado y confirmado con S. suis serotipo 2 (o 1/2) por presencia en tejidos mediante cultivo o presencia de ADN mediante qPCR en tejidos (válvulas cardiacas, articulaciones, meninges) de cerdos eutanasiados y bajas súbitas. Sin embargo, los cerdos que fueron tratados y sobrevivieron no fueron diagnosticados. Además, no todos los cerdos identificados con signos clínicos fueron muestreados durante este estudio; los casos detectados durante el fin de semana o sin los recursos humanos para un muestreo adecuado fueron excluidos y medicados inmediatamente.
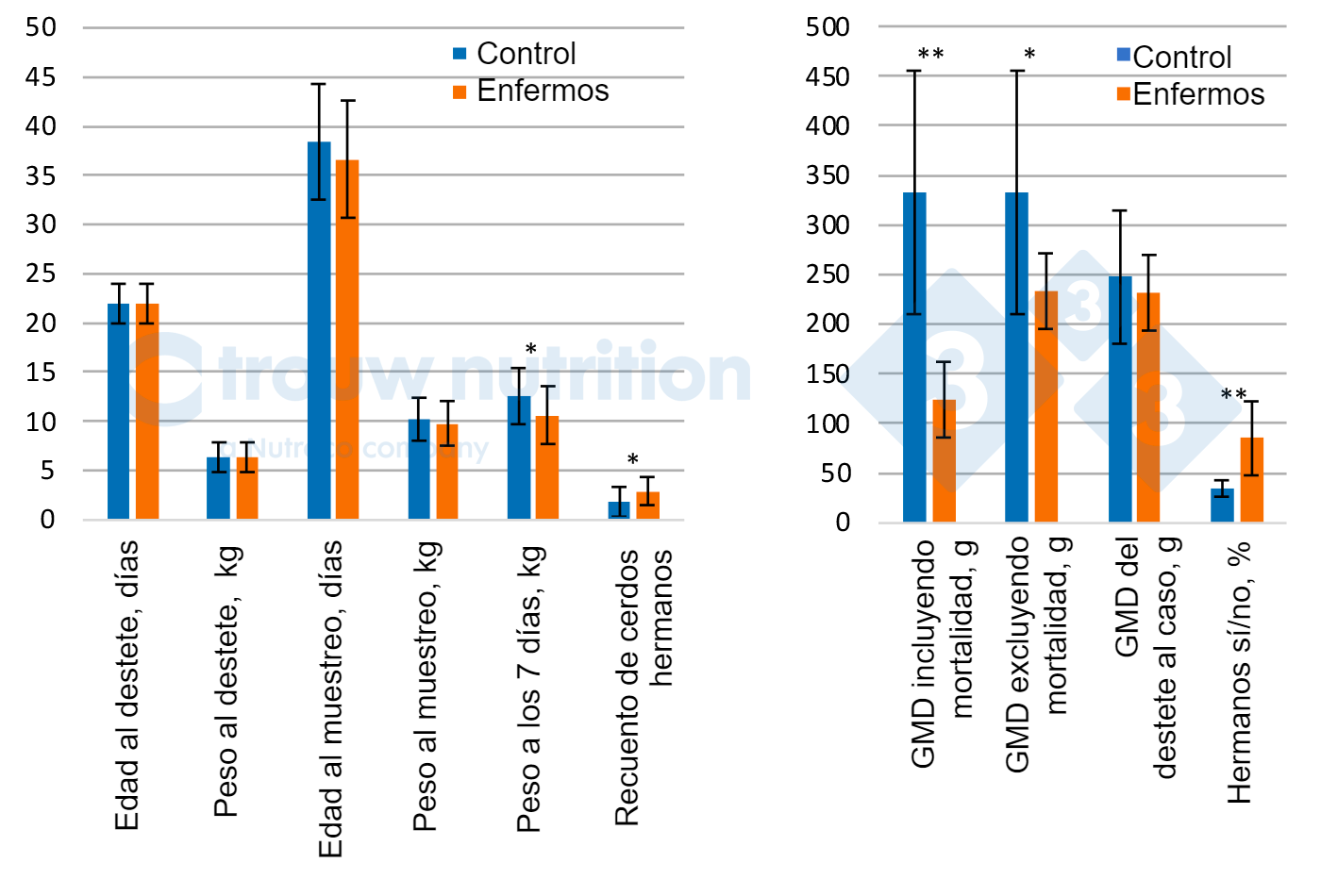
Se tomaron muestras de un total de 56 lechones, 28 de ellos fueron sospechosos de padecer la enfermedad por S. suis con signos clínicos incluyendo 20 clasificados como gravemente enfermos (signos neurológicos). Los datos se refieren únicamente a los cerdos afectados neurológicamente frente a los del grupo control (Figura 2 A y B).
Los cerdos control y los enfermos presentaron un peso y una edad similares en el momento de la detección de los signos clínicos y no difirieron retrospectivamente en cuanto al peso de destete o la ganancia media diaria entre el destete y el muestreo (P > 0.05), lo que sugiere que no existe una condición previa clara como sería un animal con un rendimiento extremadamente pobre o bueno. Durante los 7 días posteriores a la detección de la enfermedad, los cerdos redujeron su rendimiento como era de esperar (P <0.05).
Retrospectivamente, se observó un efecto significativo de camada/cerda con una mayor proporción de lechones hermanos dentro de los cerdos afectados con signos neurológicos que los controles (P < 0.02), lo cual es bien conocido e indica el efecto de la cerda en la transferencia vertical del estado de portador, pero quizás también un factor de susceptibilidad. El rendimiento de la cerda no mostró diferencias entre los cerdos enfermos o afectados neurológicamente y el control, lo que reduce la predictibilidad de los factores de riesgo potenciales a partir del rendimiento de la cerda (datos no mostrados). La prevalencia del serotipo 2 de S. suis aumentó significativamente (P<0.04) en los cerdos gravemente enfermos (81%) frente a los del grupo control (44%), lo que concuerda con nuestros hallazgos diagnósticos.
Se observó un perfil fisiopatológico general en los parámetros sanguíneos de los cerdos enfermos con signos neurológicos (tabla 1), con un aumento del pH, la saturación de O2 y la incidencia de alcalosis, pero una reducción de la glucosa, pCO2, iCa, Ca, P, Mg, K y Na en sangre/suero en comparación con el control (P<0.05). La alcalosis respiratoria que se observó estaba probablemente relacionada con la acidificación del líquido cefalorraquídeo (por la acumulación de lactato) por la pleocitosis (aumento del recuento de glóbulos blancos en el líquido cefalorraquídeo). La meningitis puede causar síndrome cerebral de pérdida de sal, alterando el sistema simpático, la diuresis y la función renal, lo que explica la pérdida de minerales en este estudio.
Tabla 1. Principales diferencias en el análisis bioquímico de la sangre y el análisis de los minerales en sangre o suero de los cerdos enfermos con signos neurológicos (n = 20) y los controles (n = 28).
| Control | Enfermos | raíz de la desviación cuadrática media (RMSE)- | P-valor | |
|---|---|---|---|---|
| pH (sangre) | 7.30 | 7.41 | 0.095 | <,001 |
| PCO2 (sangre), mmHg | 52.5 | 41 | 9.858 | <,001 |
| PO2 (sangre), mmHg | 35.5 | 39.4 | 11.69 | 0.258 |
| sO21 (sangre), mmol/L | 57.1 | 67.6 | 17.16 | 0.045 |
| Exceso de base (sangre), mmol/L | -1.39 | 1.4 | 4.875 | 0.062 |
| Incidencia de alcalosis, % | 10.7 | 42.2 | 13.2 | 0.019 |
| Na (sangre), mmol/L | 139 | 137 | 3.265 | 0.008 |
| K (sangre), mmol/L | 5.21 | 4.49 | 0.791 | 0.004 |
| iCa (sangre), mmol/L | 1.38 | 1.27 | 0.066 | <,0001 |
| Ca (suero), mmol/L | 2.59 | 2.33 | 0.151 | <,0001 |
| Glucosa (sangre), mg/L | 117.5 | 82.3 | 21.51 | <,0001 |
En niños con meningitis, un nivel bajo de Na se asocia con un mayor riesgo de gravedad de la enfermedad y mayor mortalidad (Chao et al., 2008) y el Ca bajo (total e ionizado) es frecuente en niños con enfermedad meningocócica grave. El Mg interactúa con la secreción de parathormona en respuesta a la hipocalcemia y podría contribuir a la pobre homeostasis mineral en el presente estudio.
Se puede especular que la intervención mineral y electrolítica, tal como se corrige actualmente en los pacientes humanos con meningitis, también puede ser beneficiosa para los cerdos, y se necesita más investigación en esta línea utilizando estudios de infección controlada en lugar del enfoque práctico del caso actual.
En conclusión, la meningitis en lechones enfermos (de manera natural) se asoció con un rendimiento promedio, sin ningún rasgo productivo previo a la enfermedad que destacar, aparte de un efecto cerda/camada. Los lechones enfermos mostraron alcalosis respiratoria, pérdida de minerales y una mayor prevalencia de S. suis serotipo 2 (y/o 1/2).
Extraído del estudio: Metabolic insights and background from naturally affected pigs during Streptococcus suis outbreaks. Fabà L, Aragón V, Litjens R, Galofré-Milà N, Segura M, Gottschalk M, Doelman J. Translational Animal Science, Volume 7, Issue 1, 2023, txad126.
