Etiología de la enteropatía proliferativa porcina (ileítis)
30-mar-2007 (hace 18 años 1 días)
El agente causal de la enteropatía proliferativa porcina (EPP, ileítis porcina) es la bacteria intracelular estricta Lawsonia intracellularis, que crece preferentemente en el citoplasma de las células del epitelio intestinal (McOrist et al., 1995). El crecimiento de esta bacteria se ve acompañado invariablemente de la proliferación localizada de células epiteliales inmaduras de las criptas que están infectadas.
Hasta el momento, no se ha podido cultivar esta bacteria en un medio acelular, probablemente porque su metabolismo depende de los trifosfatos formados en las mitocondrias o de una fuente de energía similar localizada en el interior de la célula hospedadora. Este fenómeno de “parasitismo energético” es similar al observado en otras bacterias intracelulares estrictas como las especies de los géneros Chlamydia y Rickettsia, aunque Lawsonia no posee un parentesco cercano con estas bacterias.
Algunos de los primeros artículos publicados otorgaban a esta bacteria intracelular características similares a las bacterias del género Campylobacter, una atribución que sin embargo se basaba exclusivamente en la similitud morfológica con dicho género. Si bien es cierto que algunas especies del género Campylobacter, en particular C. mucosalis (Lawson y Rowland, 1974), C. hyointestinalis, C. jejuni y C. coli, pueden aislarse de las lesiones proliferativas, la inoculación de estas bacterias a cerdos nunca ha generado la aparición de lesiones proliferativas específicas o la colonización intracelular. Este hecho indica que tales agentes infecciosos se aprovechan de las condiciones anómalas existentes en el intestino para poder colonizarlo y son, por tanto, patógenos secundarios. Este fenómeno de colonización por otras bacterias secundarias se observa de manera similar en otras enfermedades intestinales del cerdo, como es el caso de la disentería porcina.
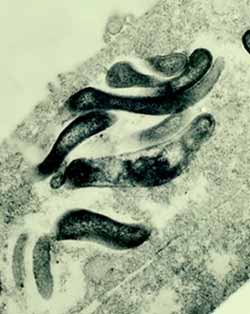 |
| Fig. 1. Lawsonia intracellularis en el interior de un enterocito cultivado (microscopio electrónico de transmisión). |
L. intracellularis tiene el aspecto de un bastoncillo vibrioide, curvado o recto y de extremos agudos o romos, de 1,25-1,75 µm de largo y 0,25-0,43 µm de ancho. Presenta la membrana externa trilaminar característica de las bacterias gramnegativas (fig. 1) y no se han detectado fimbrias o esporas. En algunas cepas aisladas de cultivos celulares de laboratorio se ha observado un único flagelo polar, largo y de motilidad pulsátil, pero solo cuando las bacterias se encuentran en el medio externo, fuera de las células.
Lawsonia posee un genoma circular sencillo de pequeño tamaño y 3 megaplásmidos que en conjunto suman únicamente 1,72 millones de pares de bases de ADN y 1.324 marcos de lectura abierta de lectura (genes funcionales). A este genoma de pequeño tamaño se suma una respiración dependiente de la célula (“parásito energético”), un ADN con una baja proporción de G+C y una expresión significativa de las proteínas de choque térmico GroEL, todas ellas características que se observan con frecuencia en otras bacterias intracelulares estrictas y simbiontes (Dale et al., 1998, McOrist y Gebhart, 2004).
A pesar de estar clasificado dentro de la familia Desulfovibrionaceae, a partir del análisis de su secuencia de ADN, Lawsonia no parece poseer capacidad para reducir los sulfatos. Un hecho importante es que, a diferencia de las especies del género Desulfovibrio, esta bacteria parece haber adquirido un mecanismo activo para penetrar en la célula y un mecanismo que afecta a las células hospedadoras que son su blanco in vivo.
Las secuencias de ADN de las cepas de L. intracellularis aisladas de los cerdos y de otras cepas obtenidas de diversas fuentes y de células hospedadoras de otras especies (hámster, caballo, ciervo) manifiestan un alto grado de similitud (> 98%) en las secuencias de ADN correspondientes a puntos taxonómicos clave y en las proteínas de la membrana externa, lo que avala la posible existencia de una única “cepa” homogénea de L. intracellularis (Cooper et al., 1997). Estas características revelan que la considerable deriva genética descrita en el género Desulfovibrio y en otras bacterias ancestrales se ha producido recientemente. Esto se debe a que el desarrollo de varias “cepas” requiere, por lo general, cierto tiempo para materializarse y detectarse.
Algunas cepas de Lawsonia han sido modificadas in vitro mediante cultivo en pases repetidos. En esta técnica, se transfiere una cepa aislada del cultivo a la siguiente placa de cultivo, en un proceso que se repite un gran número de veces. Este proceso propicia a menudo la aparición de una cepa avirulenta o atenuada, y en el caso que nos ocupa, se pudo utilizar con éxito una cepa para la obtención de una vacuna (Kroll et al., 2004). Esta forma de atenuación bacteriana fruto del cultivo en pases repetidos, es por lo general el resultado de un proceso de delección génica en el que se pierden los genes responsables de la capacidad patogénica mientras que se conservan los genes que garantizan la infectividad.
El cultivo in vitro de L. intracellularis exige el cocultivo con una estirpe de células transformadas como células epiteliales intestinales o fibroblastos de McCoy, en una atmósfera microaeróbica compuesta por un 82,2% de nitrógeno, un 8,8% de dióxido de carbono y un 8% de oxígeno, a una temperatura de 37ºC (Stills 1991, Lawson et al., 1993). El bajo nivel de oxígeno de los cultivos refleja el bajo nivel de oxígeno que, en circunstancias normales, se da en el íleon del cerdo.
Los estudios de transmisión experimental con cultivos puros de L. intracellularis administrados en forma de inóculos orales a cerdos normales y a cerdos gnotobióticos que han recibido previamente una flora bacteriana mínima de especies intestinales no patógenas han permitido reproducir las lesiones específicas de la enteropatía proliferativa (McOrist et al., 1993, 1994). En otras palabras, estos estudios cumplieron los postulados de Koch. La exposición de los cerdos a un homogeneizado de mucosa afectada, ya sea bruto o parcialmente filtrado, se tradujo, en los primeros estudios de este tipo, en la aparición de las lesiones intestinales y de la enfermedad clínica características (Roberts et al., 1977; Mapother et al., 1987; McOrist y Lawson, 1989a). Esta estrategia fue retomada posteriormente mediante un modelo de exposición con un homogeneizado de mucosa bien caracterizado, destinado a reproducir la enteropatía proliferativa en cerdos normales (Winkelman et al., 2002, Guedes y Gebhart 2003a, b).
Las lesiones intestinales que se desarrollan como consecuencia de la exposición artificial a diversas cepas comparten todas las características de la enfermedad observada en el entorno natural, incluida la existencia de proliferación en la mucosa y la presencia de bacterias en el interior de las células (McOrist et al., 1993; Guedes y Gebhart, 2003a, b). Tanto las cepas de L. intracellularis de origen americano o europeo como las cepas aisladas de lesiones agudas o crónicas han demostrado su capacidad para producir las lesiones típicas de la enteropatía proliferativa aguda y crónica (Mapother et al., 1987; Knittel et al., 1996). Esta observación indica que las diferentes manifestaciones clínicas de la enteropatía proliferativa, como la adenomatosis intestinal porcina, la enfermedad subclínica o la enteropatía hemorrágica proliferativa, se deben a diferencias en la ingesta de la dosis oral de bacterias y en la respuesta individual del hospedador, y no a la existencia de “cepas” bacterianas diferentes.
