Los procesos respiratorios en la especie porcina tienen una etiología multifactorial en la que están implicados diferentes factores: agentes infecciosos, nutrición y causas predisponentes de manejo como la temperatura, ventilación, densidad de población, condiciones de las instalaciones, etc.
Los agentes infecciosos descritos en el Complejo Respiratorio Porcino (CRP) que tienen mayor relevancia son:

- Bacterias: Mycoplasma hyopneumoniae, Actinobacillus pleuropneumoniae, Haemophilus parasuis, Pasteurella multocida, Streptococcus suis y Mycoplasma hyorhinis.
- Virus: PRRS, Influenza virus, PCV2, Coronavirus respiratorio.
- Parásitos: Metastrongylus spp.
El análisis laboratorial ofrece una información detallada de la presencia de los agentes infecciosos implicados que posibilita una mejor decisión para la aplicación de medidas efectivas. En función de la disponibilidad y el objetivo del análisis (diagnóstico de caso clínico o monitorización de la explotación) se pueden analizar diferentes tipos de muestras (Tabla 1).
TABLA 1: Tipo de muestras respiratorias, ventajas e inconvenientes.
| TIPO DE MUESTRA | VENTAJAS | INCOVENIENTES |
| Pulmones |
|
|
| Lavados broncoalveolares o raspados bronquiales |
|
|
| Fluidos orales |
|
|
| Hisopos nasales |
|
|
Los lavados broncoalveolares y raspados bronquiales (figura 1) son muy útiles en procesos respiratorios dónde no hay bajas pero sí aparecen animales con signos respiratorios como toses o disnea. Permite muestrear un número importante de animales agrupándolos por edades, naves o estado de producción. Aporta información exacta de los microorganismos presentes a nivel pulmonar.
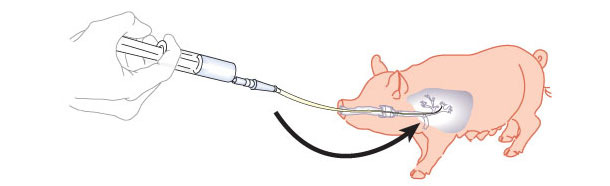
La metodología es sencilla y rápida una vez familiarizado con ella. En el siguiente video, se muestra un video explicativo de la realización de la técnica. El acceso puede ser vía oral o nasal y es necesario contar con material adecuado con diferentes tipos de sondas en función de la edad del animal y del tipo de acceso.
El protocolo para obtener un raspado bronquial es el mismo que en caso del lavado con la salvedad que no se introduce solución salina. Una vez que la sonda ha alcanzado el nivel bronquial se retira y se corta la parte distal del catéter introduciéndola en un tubo con 1-2 ml de solución salina estéril.
Para evaluar qué metodología para la toma de muestra presentaba mayor eficacia en la detección de los agentes infecciosos descritos se realizó un trabajo donde se comparaban los resultados obtenidos a partir de lavados broncoalveolares y raspados bronquiales mediante la técnica de PCR en tiempo real (qPCR).
Un grupo de 68 animales pertenecientes a tres granjas diferentes fue sujeto de este estudio. Este grupo de animales incluía animales en las principales etapas de producción: animales lactantes (n=1), destetados (n=11), hembras reproductoras (n=17), animales de recría o reposición (n=12) y animales en cebo con peso entre 30 kg y 100 kg (n=27).
Ambos tipos de muestra, lavados broncoalveolares y raspados bronquiales, fueron tomados de cada animal. Posteriormente se obtuvieron los ácidos nucleicos (DNA y RNA) de cada muestra a través de un sistema automático de extracción y se utilizaron kits qPCR para la detección molecular de los siguientes parámetros: PRRSV, PCV2, virus influenza A, Mycoplasma hyopneumoniae, Mycoplasma hyorhinis, Actinobacillus pleuropneumoniae, Haemophilus parasuis y Streptococcus suis. Se consideró positiva toda muestra con un valor Cq < 38.
Todos los agentes infecciosos fueron detectados en ambos tipos de muestras, los resultados se muestran en la tabla 2.
Tabla 2: Resultados qPCR de los parámetros analizados en ambos tipos de muestra expresados en porcentajes de muestras positivas.

| Parámetro | LAVADO | RASPADO |
| PRRSV | 31,1 | 30,7 |
| PCV2 | 3,9 | 4,0 |
| Influenza A virus | 2,6 | 5,3 |
| M. hyopneumoniae | 26,0 | 29,6 |
| M. hyorhinis | 62,3 | 77,3 |
| A. pleuropneumoniae | 16,9 | 22,7 |
| H. parasuis | 44,2 | 46,7 |
| S. suis | 50,0 | 87,84 |
Los resultados fueron comparados estadísticamente utilizando el test exacto de Fisher dado el tamaño reducido del tamaño muestral. Sólo se encontraron diferencias significativas para la detección de M. hyorhinis y de S. suis. En estos parámetros la detección en la muestra de raspado bronquial sí fue más elevada. No se observaron diferencias significativas en los niveles de detección para el resto de parámetros estudiados.
Muchos veterinarios de campo encuentran el muestreo mediante raspado bronquial menos invasivo y sobre todo más sencillo de recoger que los lavados broncoalveolares. Además de estas ventajas deberíamos considerar la equivalente o incluso mejor capacidad de detección a través de los raspados bronquiales para los principales patógenos de interés en el CRP. Serían deseables estudios posteriores en los que se aumente el tamaño muestral, se analice en detalle otras variables como la edad de los animales y los resultados cuantitativos en los agentes que proceda. No obstante, podríamos concluir que el raspado es un método eficaz de muestreo y puede establecerse como una alternativa válida a los lavados broncoalveolares.



