La respuesta inmunitaria a la infección por el tipo 1 y 2 de PRRSV es parecida. Es decir, se induce una respuesta antígeno-específica tanto humoral como mediada por células, se generan anticuerpos para varias proteínas víricas, se elimina la infección y se crea una respuesta de memoria que proteje contra futuras exposiciones. Sin embargo, la respuesta a los dos genotipos de virus es cuantitativamente distinta en algunos aspectos importantes. Tanto la severidad de la infección como la intensidad de la respuesta inmune son menores en las infecciones por PRRSV tipo 1 que en las de tipo 2. Como consecuencia, la inmunidad contra reinfecciones es más difícil de estudiar en los modelos de infección por tipo 1 ya que la enfermedad puede ser más difícil de demostrar al poder producirse una infección asintomática. Por lo tanto, pueden producirse interpretaciones erróneas al no disponer de controles positivos ni negativos fiables. A causa de este problema la mayoría de la investigaciones sobre inmunidad y vacunaciones se centran en el tipo 2, en el que la enfermedad clínica puede reproducirse y demostrarse tanto en los modelos respiratorios como en los reproductivos. Esta limitación es relevante ya que el tipo 1 es el que predomina en Europa, mientras que en Asia y Norteamérica es más frecuente el tipo 2.
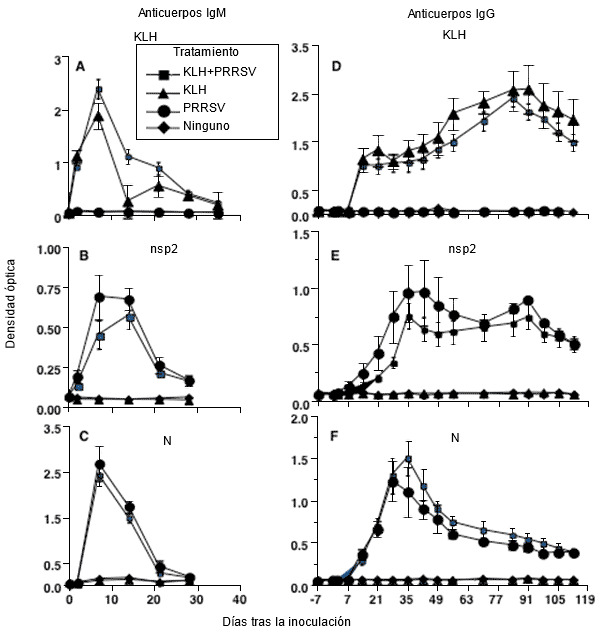

Figura 1. Cinética de la respuesta de anticuerpos frente a una infección por PRRSV tipo 2 donde se muestra que la respuesta a proteínas individuales de PRRSV es la misma que frente a una proteína antígenica no relacionada como la KLH (hemocianina de la lapa californiana) (modificado de Mulupuri et al. 2008. J. Virol. 82:358-370).
Cuando los cerdos no expuestos se infectan por primera vez con PRRSV se produce una respuesta immune innata con evidencia de inducción por interferón en los virus virulentos. Los virus poco virulentos no presentan la inducción por interferón. Algunas proteínas virales bloquean la respuesta innata del interferón pero, independientemente de la efectividad de la inmunidad innata contra el PRRSV, se observa una respuesta humoral normal que incluye una rápida producción de IgM contra varias proteínas virales, que después son substituidas por IgG contra las mismas proteínas. La cinética de la respuesta es idéntica a la producida por un antígeno control no infeccioso. Las células plasmáticas secretoras de antígenos específicos contra PRRSV y las células B de memoria se encuentran básicamente en el bazo y en los tejidos linfoides que drenan los pulmones y los órganos reproductivos. Las tonsilas son el origen primario de las células B de memoria. Los anticuerpos neutralizantes aparecen más adelante, hacia el final de la viremia y lo hacen en menor número.
La inducción de las células de memoria B y T es crítica para la protección vírica específica contra una infección futura, por lo que son elementos esenciales de la inmunidad protectiva. Las células de memoria específicas para PRRSV se producen rápidamente y responden frente a proteínas virales individuales en cultivos celulares. Sin embargo, la exposición de cerdos inmunes no produce una reacción anamnésica clásica. Por lo tanto no puede predecirse el estatus inmunitario examinando la respuesta serológica tras la exposición. Hay que determinar la eficacia protectora mediante los resultados virológicos y clínicos que indicarán si hay reducción o prevención de la infección y de la enfermedad. Los estudios con exposición muestran, de un modo consistente, que la inmunidad inducida por vacunas vivas y por virus virulentos inducen una protección substancial frente a infecciones futuras por virus no relacionados. Todavía no se han identificado los epítopes esenciales para la protección heteróloga.
Los experimentos han mostrado varias consecuencias inmunopatológicas de la infección por PRRSV, incluyendo hipergammaglobulinemia y potenciación de la infección dependiente de anticuerpos; de todos modos, no hay evidencias de que esto ocurra en condiciones de campo. Por el contrario, los efectos inmunosupresivos de la infección viral son difíciles de reproducir experimentalmente, aunque no hay duda de que, en el campo, el estatus sanitario de la explotación cae tras un brote de PRRS.
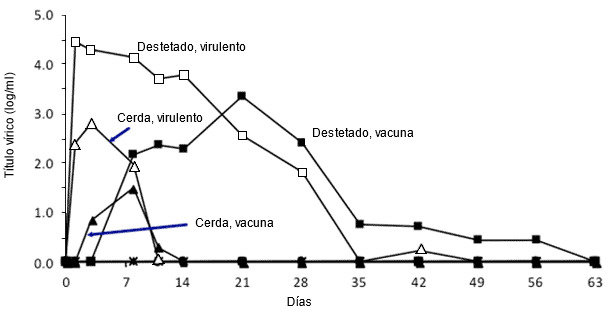
Figura 2. Efecto de la edad del cerdo sobre la multiplicación del PRRSV. Temporalización de los valores cuantitativos de viremia en lechones destetados y adultos expuestos a una cepa virulenta tipo 2 o atenuada de PRRSV (adaptado de Klinge et al. 2009. Virol J. 6:177-187).
Una amplia variabilidad es el sello distintivo de PRRS, tanto en el propio virus como en la respuesta del cerdo. Los tipos 1 y 2 de PRRSV son genéticamente distintos y dentro de cada grupo hay una gran variación. Entender la interacción de PRRSV con los cerdos es complicado debido a que la mayoría de las investigaciones se realizan con unos pocos aislados del virus, la mayoría de los cuales no son representativos de las cepas que actualmente estan causando enfermedad. Asimismo, hay una tremenda variación en la respuesta de cerdos no expuestos ante la primera infección o en la de cerdos inmunizados ante una cepa de campo. Por ejemplo, los cerdos de engorde y las cerdas adultas tienen una mayor resistencia que los lechones destetados, aunque la respuesta inmune inducida por la infección parezca ser la misma en todas las edades.
Para resolver la variación entre los virus y entre las respuestas de los animales infectados se necesitará la identificación y caracterización de los epítopes clave de células B y T conservados entre distintos PRRSV y de los detalles moleculares y estructurales de los anticuerpos efectores clave, de los receptores antigénicos de las células T y de las moléculas MHC que median una amplia inmunidad cruzada.


