Caso clínico: Infección pulmonar polimicrobiana
Descripción de la granja
Se trata de una explotación de ciclo cerrado con 600 cerdas situada en una zona de Francia con baja densidad porcina. La explotación cuenta con:
- Manejo semanal
- Destete a los 21 días (20 bandas)
- Fabricación del alimento en la propia explotación
- Reemplazo propio
Origen de la primerizas: la explotación entra abuelas, a partir de las cuales se crian las hembras para reposición que serán separadas de los animales de producción a los 18 kg.
Hacia los 180 días se transfieren a una cuarentena en la que permanecerán hasta los 250 días tras los cuales son inseminadas en una sala de cubrición especial (35 plazas) y después son transferidas a las salas de gestación.
Alojamientos:
| Verracos | Cubrición | Gestantes | Maternidad |
| 6 verracos en producción | 180 cerdas alojadas en jaulas individuales |
180 cerdas en jaulas individuales 170 cerdas en grupos (grupos de 10) |
4 corrales de 30 plazas |
| Transición | Crecimiento | Engorde | |
|
4 corrales de de 280 plazas (aire filtrado) |
4 corrales de 300 plazas (alimento seco) (construcción antigua) |
19 corrales de 280 plazas (alimentación líquida) (construcción reciente) |
|
La sucesión de las naves es coherente, siempre existe una ligera sobredensidad en transición.
Situación sanitaria
Antecedentes
La explotación es indemne para Aujeszky y PRRS.
En junio de 2000 se detectó un aumento de la mortalidad en engorde pasando del 3 al 5%, afectando mayoritariamente a los cerdos que se encontraban a final de esta fase. En matadero se detectó un aumento importante de los decomisos (hasta un 10% por lote) debido a pleuresías con abscesos. Se decidió enviar muestras pulmonares de animales que aún se encontraban en la explotación y de animales sacrificados al laboratorio. El análisis bacteriológico puso de relieve la presencia de Actinobacillus pleuropneumoniae biovar 1 serovar 2 (B1S2). Tras este descubrimiento se estableció vacunar a los animales con una autovacuna siguiendo la siguiente pauta vacunal:
- Lechones: 2 inyecciones a las 6 y 10 semanas de vida.
- Primerizas: 2 inyecciones a las 6 y 10 semanas de vida y 1 de recuerdo a la entrada en cuarentena.
- Cerdas: 2 inyecciones a las 6 y 3 semanas antes del parto y en ciclos posteriores a las 3 semanas antes del parto.
Al cabo de varios meses se observó una reducción de la mortalidad y de los decomisos. Sin embargo, en matadero se continuaron observando lesiones de pleuresía (hasta un 30% de los pulmones).
Profilaxis y tratamiento
| Profilaxis | |
| Cerdas |
Mal Rojo: primerizas 2 veces + recuerdo en maternidad (15 días después del parto) Parvovirus: primerizas 2 veces + recuerdo en maternidad |
| Lechones | Micoplasma: 2 inyecciones a los 5 y 27 días de vida |
| Tratamiento | |
| Amoxicilina (20 mg/kg) el primer día de vida | |
| Alimento de primera edad con suplemento de calistenia (120 ppm) | |
Primera visita
Durante el verano de 2002, el productor avisa al veterinario tras observar presencia de desmedro y tos en la nave de transición en animales entre 5 a 6 semanas de vida, pérdidas del 6 al 8% debido a mortalidad y sacrificio de lechones con desmedro y aumento del número de decomisos por pleuresía en el matadero.
Medidas cautelares
El veterinario decide tomar las siguientes medidas cautelares: tratar a los lechones en el momento del destete con cefquinoma (2 mg/kg) por vía parenteral y un suplemento de 400 ppm de amoxicilina en la dieta de primera edad.
Segunda visita
A la semana siguiente se volvió a visitar la explotación y se visitaron todas las naves:
| Cuarentena |
|
Alrededor de un 20% de las primerizas presentaban tos. Ausencia de inmunización digestiva o respiratoria. Se observó un desarrollo normal de los animales y sin problemas en la entrada en estro. |
| Verracos - gestación |
|
Sin problemas de entrada en estro. Fertilidad: 85%. Ausencia de tos. |
| Maternidad |
|
Resultados reproductivos correctos. Buen comportamiento maternal de las madres. Diarrea neonatal sobretodo en las camadas procedentes de primeras crias (en algunas camadas la mortalidad es muy elevada). En las 2 últimas bandas se observa una fuerte tos a los 15 días de vida (15% en 2 minutos) así como artritis (3% de los lechones). |
| Transición |
|
Presencia de tos hacia las 6 semanas de vida (30% en 2 minutos) desde hace 1 mes con desmedro y mortalidad entre el 6 al 10%. Ausencia de signos digestivos. Cumplimiento de las normas técnicas y ambiente correcto. |
| Crecimiento |
|
Ausencia de síntomas digestivos o respiratorios. Heterogeneidad en los animales debido a los problemas observados en transición. |
| Engorde |
|
Hasta 80 kg: Normal A partir de 80 kg: los cerdos presentan anorexia de corta duración (1 a 2 días) y tos fuerte (15% en 2 minutos). Ausencia de mortalidad. Decomisos parciales en matadero (tórax) sobre un gran número de canales (7-8%). |
Exámenes complementarios
Se decidió realizar un control sobre un número significativo de las canales en el matadero para tener una idea precisa de la frecuencia de las lesiones observadas y orígenes de los decomisos.
Por otra parte se practicaron algunos exámenes de laboratorio para conocer el origen de los desordenes y lesiones observados:
- Necropsias
- Análisis bacteriológicos
- Análisis serológicos para PRRS
- PCR para circovirus sobre lesiones
Resultados de los exámenes
Resultados de los controles en matadero
La mayoría de controles se realizaron durante el mes de septiembre, en términos medios, entre un 80 a 90% de los pulmones no presentaron neumonía mientras que entre un 30 a 50% presentaron lesiones de pleuresía. Entre un 7 a 8% de las cavidades torácicas fueron decomisadas.
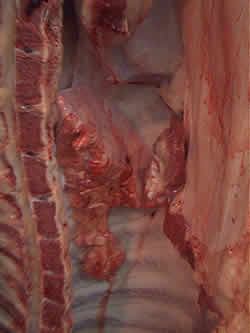 Pulmón colapsado (sin absceso) |
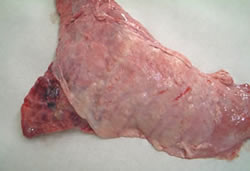 Pulmón con lesión de pleuresía con abscesos |
Exámenes laboratoriales
Lechones en lactación: se realizó la necropsia en laboratorio de un lechón de 15 días de vida. Se observó presencia de neumonía y pleuresía leve. Se aisló Bordetella bronchiseptica de los pulmones.
Lechones en transición: 3 lechones no tratados que habían empezado a presentar signos clínicos (tos, adelgazamiento) fueron sacrificados y enviados al laboratorio.
Necropsias:
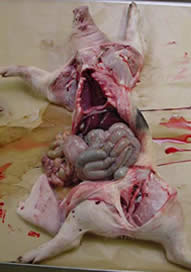 |
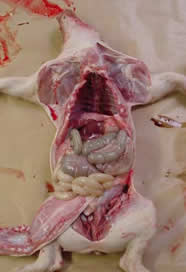 |
| Lechones de 40 días necropsiados | |
- Examen circulatorio y hemato-linfopoyético (corazón, bazo): Normal
-
Aparato respiratorio:
- Corte nasal: normal.
- Pulmones: lesiones de neumonía en los lóbulos (hepatización). Notas globales 10 a 22/28.
- Pleuresía en uno de los lechones.
- Aparato locomotor: se observa de forma general una ligera inflamación de una o más articulaciones.
- Aparato digestivo: normal
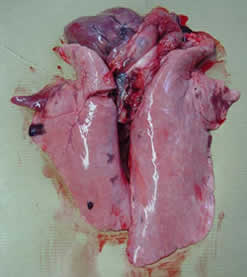 |
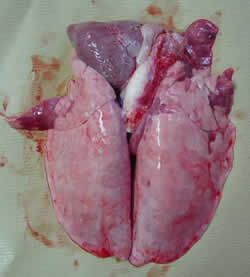 |
| Pulmones con presencia de lesiones de neumonía a nivel de los lóbulos apicales y cardíacos. Ausencia de pleuresía. | |
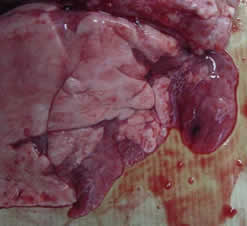 |
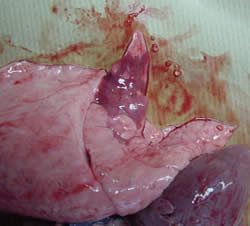 |
| Hepatización roja y atelectasia del tejido pulmonar | |
Bacteriología
- Pulmones: se aísla Haemophilus parasuis en 2 de 3 lechones (en las lesiones de neumonía).
- Articulaciones: No se evidenció la presencia de ningún germen significativo en las lesiones de artritis.
- Bacteriología sobre pulmones tomados en el matadero: se aisló Actinobacillus pleuropneumoniae B1S2.
Análisis serológicos para PRRS
- Se realizaron serologías sobre 10 lechones de 25 kg y 10 cerdos de engorde de 100 kg y todos los análisis resultaron negativos.
PCR para circovirus sobre lesiones
- PCR Circovirus tipo 2 sobre pulmones y ganglios: todos los análisis resultaron negativos.
Diagnóstico
Debido a la ausencia de PCV2 en los tejidos lesionados la circovirosis fue excluida de las hipótesis sobre el diagnóstico, de forma que los síntomas de desmedro observados en transición probablemente no se pueden vincular con presencia del síndrome del desmedro (PMWS).
El aislamiento de Bordetella bronchiseptica de pulmones de un lechón lactante, de Haemophilus parasuis en las lesiones de neumonía de lechones en transición y de Actinobacillus pleuropneumoniae en las lesiones de pleuresía de los pulmones recogidos en matadero hizo sospechar de una infección pulmonar multifactorial.
Medidas tomadas y evolución
1. Acondicionamiento de las primerizas en cuarentena:
- Contaminación digestiva: exposición a excrementos de cerdas en maternidad de 2 a 3 veces por semana durante toda la cuarentena.
- Contaminación respiratoria: puesta en contacto nariz a nariz con una cerda de desvieje (en buen estado de salud).
2. Instauración de una nueva autovacuna:
Reproductores:
- Actinobacillus pleuropneumoniae B1S2 (cepa aislada en octubre de 2002).
- Haemophilus parasuis (cepa aislada en noviembre de 2002).
- Bordetella bronchiseptica (cepa aisladas en noviembre de 2002).
==> 2 inyecciones (5 ml) en las cerdas a las 6 y 3 semanas antes del arto y en ciclos posteriores una 3 semanas antes del parto.
==> 2 inyecciones (2 ml) en las primerizas a las 7 y 11 semanas de vida y dosis de recuerdo (2 ml) a la entrada en cuarentena.
Demás animales:
- Actinobacillus pleuropneumoniae B1S2 (cepa aislada en octubre de 2002).
- Haemophilus parasuis (cepa aislada en noviembre de 2002).
==> 2 inyecciones (2 ml) a las 7 y 11 semanas de vida.
Observación: la vacunación se retrasó una semana con el fin de proteger a los cerdos durante el mayor tiempo posible.
3. Instauración de tratamientos antibióticos sobre los lechones en espera del efecto esperado de la vacunación.
- Lechones lactantes: amoxicilina (20 mg/kg) durante el primer día de vida vía parenteral + Oxitetraciclina LO (30 mg/kg) en el momento del destete por vía oral.
- Lechones en transición: suplementación de la dieta de primera edad con 400 ppm de amoxicilina.
- Crecimiento: singuna intervención.
- Engorde: marbofloxacina (2mg/kg) 3 veces con un intervalo de 24 horas en los animales con síntomas hacia los 150-160 días de vida.
4. Desinfección del ambiente
- Con el fin de disminuir la presión de infección en el aire en las naves de transición, crecimiento y engorde, una vez al día se pulveriza un desinfectante.
Evolución del caso
En la actualidad la patología ha quedado estabilizada gracias a la prevención mediante antibióticos. Deberá realizarse un seguimiento de los resultados durante los meses siguientes con el fin de poder valorar el efecto de la auto-vacunación y de la contaminación de las primerizas.
Comentarios
El caso aparece en una explotación de ciclo cerrado y se debe a una infección pulmonar polimicrobiana (Actinobacillus pleuropneumoniae, Haemophilus parasuis y Bordetella bronchiseptica). Este caso da lugar a posteriori a varios comentarios:
El siguiente esquema resume el papel de los diferentes agentes patógenos existentes en esta explotación:
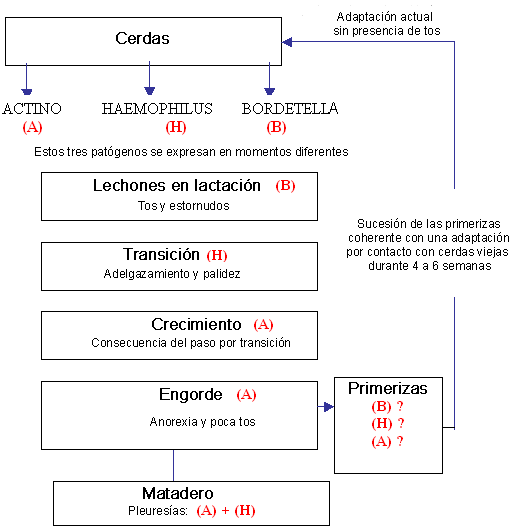
Las primerizas, aunque proceden de la misma explotación (autoreemplazo), poseen un microbismo propio y por lo tanto un status inmunitario muy diferente al de las cerdas que se encuentran en producción. Es por ello que se hace necesario conseguir una inmunización a nivel digestivo y respiratorio. De esta forma, las primerizas desarrollaran una inmunidad que podrán transmitir a sus lechones tras el parto. Mediante este tipo de medida se espera ofrecer una mejor protección a los lechones frente a los gérmenes digestivos (responsables de diarrea) y gérmenes respiratorios (responsables de la tos en maternidad y transición.
Las primerizas son portadoras de Actinobacillus pleuropneumoniae B1S2 y la autorenovación es un obstáculo para el saneamiento de la explotación. En este punto debemos preguntarnos sobre que medidas nos permitirán parar la circulación de este germen entre los reproductores, ¿la autovacunación será suficiente?
La PCR para circovirosis nos permitió confirmar la ausencia de PMWS. Este método, aunque controvertido, pareció una herramienta herramienta interesante en el diagnóstico de esta patología.
Respecto a Haemophilus parasuis, este mostró tener una virulencia particular en transición en esta explotación indemne para PRRS y PMWS. Llegados a este punto podríamos preguntarnos por la existencia de de cepas de Haemophilus parasuis hiperpatógenas.Por otra parte, ¿qué importancia debemos concederle a la presencia de Bordetella en este caso?
