Salud intestinal: estimular la colonización de una microbiota beneficiosa
02-abr-2019 (hace 5 años 11 meses 28 días)
Se calcula que nuestros cerdos tienen un total de 1010-1012 bacterias en el intestino, un número que multiplica por 10 el total de células de su cuerpo (Luckey, 1972). Es indispensable que tengamos en cuenta este componente bacteriano cuando diseñemos las dietas para nuestros animales, porque mediante una microbiota más sana y favorable para el cerdo, podemos incidir directamente en un proceso de digestión más eficiente, mejorando el sistema inmune y aumentando los rendimientos productivos.
La influencia sobre la microbiota se puede ejercer de las siguientes formas:
Modificando la disponibilidad de nutrientes para determinadas especies bacterianas
En general, las bacterias del colon proximal tienen una gran aportación de nutrientes, provenientes de residuos no digeridos de la dieta en el tramo del intestino delgado, que se va reduciendo y limitando a medida que llegamos a las regiones distales.
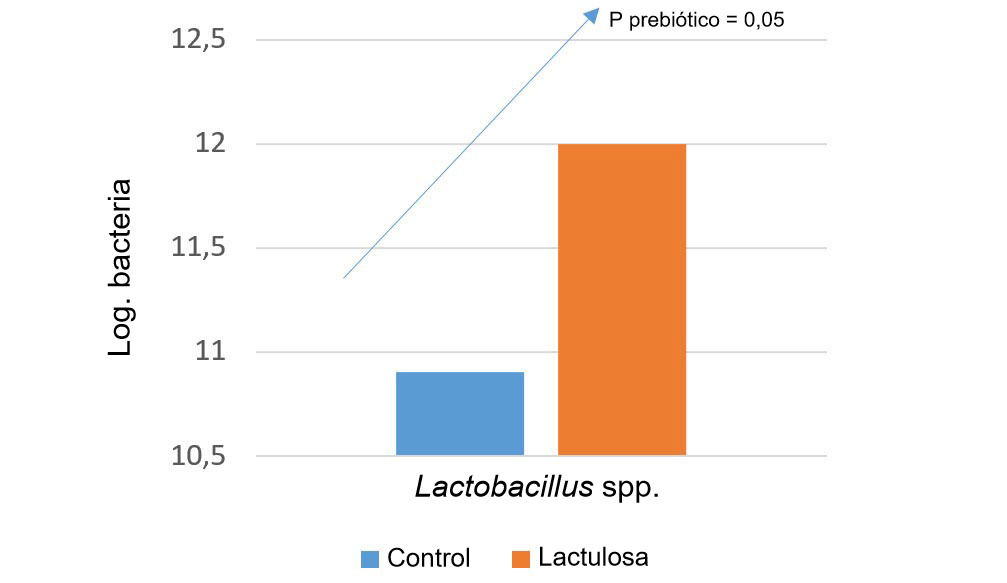
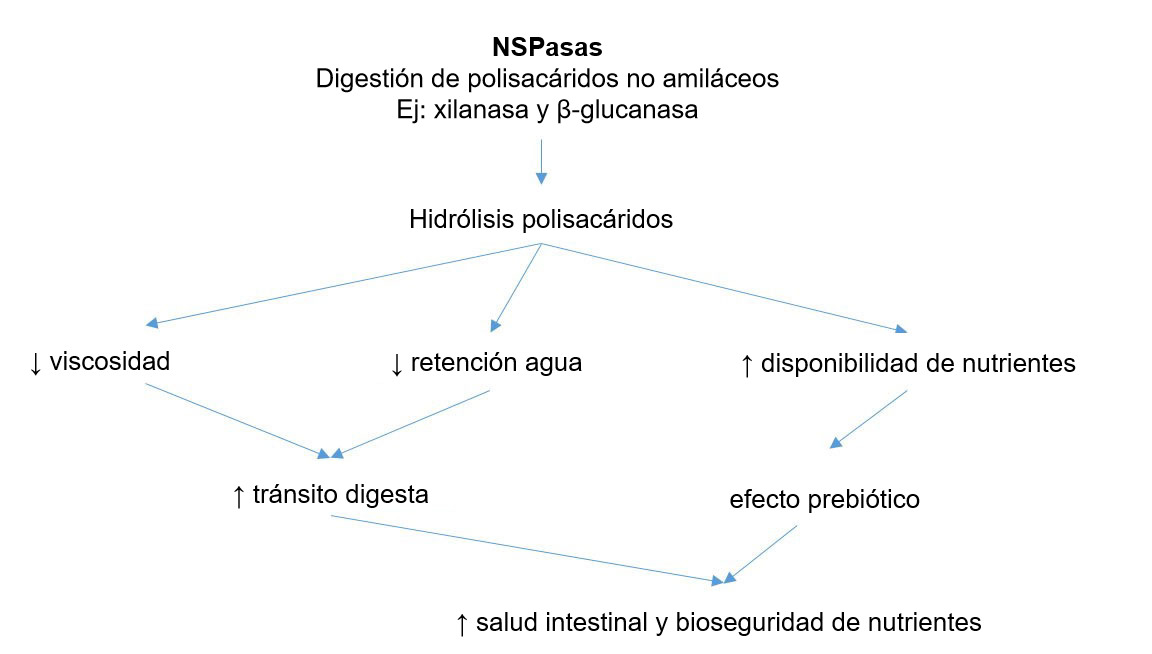
Una de las estrategias para influenciar en este aspecto son los prebióticos. El concepto de prebióticos empezó cuando se observó que la inulina y los fructooligosacaridos (FOS) estimulaban a las bifidobacterias, que se consideran buenas para la salud intestinal (Gibson y Roberfroid, 1995). En la actualidad hay mucha bibliografía en porcino que sostiene el uso de prebióticos para seleccionar Bifidobacterium spp., Lactobacillus spp., Bacteroides spp., etc. También se atribuye esta capacidad de influenciar la microbiota a la inclusión en la dieta de cierto nivel de fibra fermentable, para estimular la fermentación colónica (Correa-Matos, 2003); a la reducción de los niveles de proteína en la dieta, para evitar la fermentación proteica (Pérez, 2013); y a la inclusión de enzimas exógenas, al producir oligosacáridos con efecto prebiótico a partir de polisacáridos no amiláceos (Bedford, 2004).
A su vez, también se puede planificar un tratamiento probiótico con el objetivo de modificar los nutrientes presentes en el intestino. Para empezar, se puede diseñar una estrategia con el fin de reducir nutrientes específicos y comprometer el crecimiento de bacterias patógenas, fomentando una población más favorable para nuestros cerdos. Estos objetivos se consiguen mediante el uso de bacterias probióticas que compiten por estos nutrientes y los utilizan más eficientemente (Gerritsen et al., 2011). Por otro lado, otras estrategias probióticas se basan en el cross-feeding, que consiste en aportar un probiótico que proporcione productos metabólicos específicos para fomentar las bacterias que más interesan. Un ejemplo de esta práctica seria el estudio de Belenguer et al. (2006) dónde, mediante la producción de lactato y acetato por parte de bifidobacterias, estimulaba el crecimiento de otras bacterias butirogénicas (aportando energía para los colonocitos).
Provocando cambios en el entorno
Los cambios en el entorno fermentativo y pH también influencian el perfil de la microbiota. Esto se puede lograr directamente con acidificantes o, de forma indirecta, con probióticos, por ejemplo, con bacterias ácido-lácticas, que producen ácido láctico como metabolito mayoritario (Yang et al., 2015). La fermentación de los prebióticos como los FOS o la inulina, también resulta en una producción de ácidos orgánicos, que reducen el pH intestinal y dificultan la colonización por enterobacterias o clostridios sensibles a este pH ácido.
Interfiriendo en la comunicación bacteriana (Quorum Sensing)
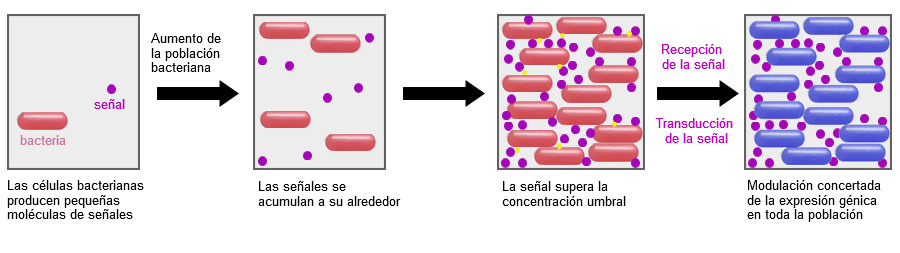
Una línea de investigación muy prometedora es interferir en el Quorum Sensing (QS), el mecanismo de comunicación entre bacterias. Esta comunicación tiene lugar mediante moléculas de señalización y les permite crear una respuesta coordinada, activando o desactivando la expresión de determinados genes y, eventualmente, actuando como un colectivo, proporcionándoles ventajas de supervivencia como la formación de biofilm o esporulación (Hughes y Sperandio, 2008). Mediante el uso de probióticos específicos, que liberen otras moléculas de señalización, o en su defecto, enzimas que hidrolicen las moléculas de señalización presentes, podemos incidir en estas vías de QS (Brown, 2011). No obstante, cabe mencionar que mucha de la información que tenemos actualmente disponible sobre la comunicación bacteriana es a nivel in-vitro, y será interesante ver si los resultados de pruebas in-vivo son consistentes o dependen del entorno gastrointestinal del animal.
Modificando los patrones de colonización y desarrollo del tracto gastrointestinal
Para terminar, vale la pena apuntar que las primeras semanas de vida son una etapa donde todas estas estrategias serán potencialmente mucho más efectivas y duraderas. Por un lado, se ha descrito que la microbiota neonatal es relativamente dinámica y muy influenciada por el ambiente y la microbiota materna. Por otro lado, la composición microbiana en esta etapa es determinante para el futuro, hecho conocido como "microbial imprinting" (Konstantinov et al., 2006). A su vez, también se sabe que la microbiota juega un papel esencial en la educación del tracto gastrointestinal inmaduro para generar sistemas funcionalmente eficientes cuando el animal sea adulto (Lewis et al., 2012). Esto es evidente en estudios con animales germ-free, donde se ha descrito que los animales sin microbiota tienen un sistema inmune y arquitectura intestinal sub-desarrolladas (Luczynski et al., 2016). Asimismo, también se ha demostrado en estudios de granja, donde se han relacionado los animales expuestos a una mayor diversidad microbiana desde su nacimiento con un perfil microbiano más sano, adaptable a cambios ambientales y más resistente a bacterias potencialmente peligrosas (Mulder et al., 2009). En conclusión, desde un punto de vista práctico, la etapa neonatal, e incluso las cerdas reproductoras, pueden ser los momentos más eficientes para influenciar sobre la microbiota, estableciendo beneficios más robustos y duraderos (Kenny et al., 2011).
