Modelización de la dinámica de infección por PCV2 en un ciclo cerrado
31-mar-2014 (hace 11 años 8 meses 13 días)
Modelización: complemento a los estudios experimentales y de campo
La modelización se utiliza cada vez más a menudo para representar y analizar sistemas biológicos complejos con sus interacciones. Según George E.P. Box “básicamente todos los modelos son incorrectos, aunque algunos son útiles” lo que refleja el principal objetivo de los estudios de modelización: representar sistemas complejos mediante una simplificación que permita su análisis, que capte el comportamiento de nuestro interés y que incorpore los procesos principales. La modelización es, de este modo, un complemento a los estudios observacionales y experimentales, a partir de la cual pueden plantearse nuevas preguntas e hipótesis.
Los estudios epidemiológicos de factores de riesgo del síndrome de adelgazamiento postdestete (PMWS) han evidenciado claramente que la dinámica de la infección por PCV2 en cerdos en crecimiento es un punto clave: cuanto más precoz es la infección, más elevado es el riesgo. Se identificaron algunas prácticas de manejo durante las primeras etapas de vida del lechón como factores de riesgo para PMWS, que pueden favorecer la transmisión de patógenos entre cerdos. Dada la posible transmisión vertical de PCV2 y la importancia de la inmunidad pasiva, se sospechó que las adopciones podrían potenciar la transmisión del PCV2 de camadas infectadas a susceptibles. Sin embargo, la relación entre los factores de riesgo identificados para PMWS y los cambios en el curso de la infección de PCV2 todavía no está completamente clara. Los estudios de modelización, al reproducir el complejo sistema de la dinámica de la población sometida a un proceso infeccioso, pueden proporcionar información útil sobre las interacciones que tienen lugar.
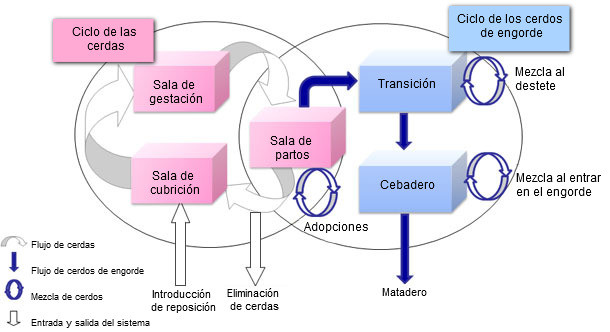
Figura 1. Representación del modelo de dinámica poblacional en cerdos
Desarrollo del modelo
El modelo de dinámica poblacional se construyó considerando cada animal de forma individual (figura 1). De hecho, el nivel de representación permite caracterizar la fuerte relación existente entre el estado de infección por PCV2 de las cerdas gestantes y de su progenie con el movimiento posterior de cada animal. Además, se optó por un modelo estocástico para tener en cuenta la variabilidad biológica de varios parámetros (número de lechones nacidos por camada, probabilidad de aborto o de mortalidad...). Por otra parte, el modelo epidemiológico se diseñó según los últimos conocimientos en cuanto al curso de la infección por PCV2 intra-hospedador (figura 2). La base era un modelo SEIR (Susceptible – Expuesto – Infeccioso – Recuperado). Sin embargo, el modelo también tenía que considerar estados de infección específicos que representasen la transmisión vertical y la pseudo-vertical así como el impacto de los anticuerpos maternales. Para representar el curso de la infección por PCV2 de un modo realista, se llevaron a cabo experimentos para caracterizar el proceso de transmisión. Estos experimentos (foto 1), basados en contactos entre animales infectados y susceptibles, con una monitorización secuencial de los lechones infectados y centinelas, permitieron estimar el coeficiente de transmisión entre animales individuales según diferentes tipos de contactos. Por otra parte, se observó que la transmisión variaba con el tiempo desde el contagio con un pico alrededor de los 15 días post-infección y una reducción posterior hasta el día 49 post-infección. Utilizando un protocolo similar también evidenciamos una reducción significativa de la tasa de transmisión en una población vacunada. El modelo final se obtuvo combinando el de población y el epidemiológico.
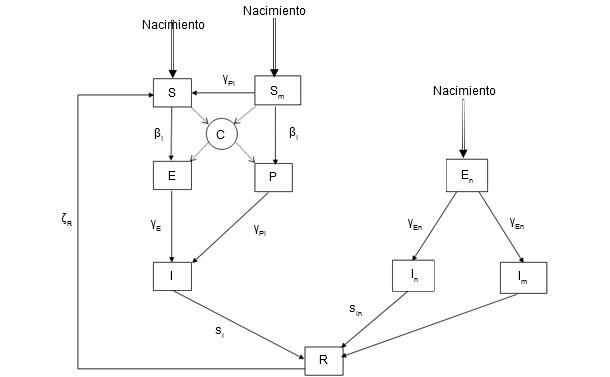
Figura 2. Modelo epidemiológico para la infección por PCV-2. Variables de estado: S: susceptible; Sm: lechones susceptibles al nacimiento con inmunidad pasiva; E: latencia para cerdos infectados sin inmunidad pasiva; P: lechones infectados por contacto con un individuo infectado mientras tiene inmunidad pasiva; I: cerdos infectados; En: lechones infectados pseudo-verticalmente por semen infectado (latencia); In: lechones infectados (pseudo-verticalmente) sin inmunidad pasiva; Im: lechones infectados (pseudo-verticalmente) con inmunidad pasiva; R: cerdos recuperados, esta clasificación representa que los cerdos ya no son transmisores.

Foto 1. Experimento de transmisión para estimar los coeficientes de transmisión del modelo de PCV2.
Lecciones aprendidas a partir del modelo
La edad de infección, el principal factor de riesgo para la manifestación del PMWS, fue la variable estudiada en función de doce combinaciones de estrategias de manejo basadas en las adopciones y en el alojamiento de lechones durante la transición. Se observó que la reducción de la mezcla de los lechones lactantes y durante la transición retrasaba el proceso infeccioso, reduciendo el número de infecciones tempranas. La agrupación de lechones por camada en pequeñas unidades tras el destete también disminuyó significativamente la probabilidad de una infección temprana. Estos resultados mostraron la posible interacción entre los factores de riesgo identificados.
Se registraron las seroprevalencias específicas para cada edad en las dos estrategias de manejo más extremas, es decir, la más liberal (mezcla aleatoria de lechones tanto en la maternidad como en la transición con grandes corralinas en la transición) y la más restrictiva (sin adopciones y con los lechones agrupados por camadas en pequeñas corralinas en la transición). Estos resultados se compararon con los datos de seroprevalencia reales obtenidos de un estudio de campo (figura 3). Las seroprevalencias medias predichas por las simulaciones con la estrategia liberal se parecían mucho a las encontradas en las granjas con casos clínicos del PMWS, mientras que el patrón de seroprevalencias con la estrategia restrictiva era parecido al observado en las granjas infectadas subclínicamente (figura 3).
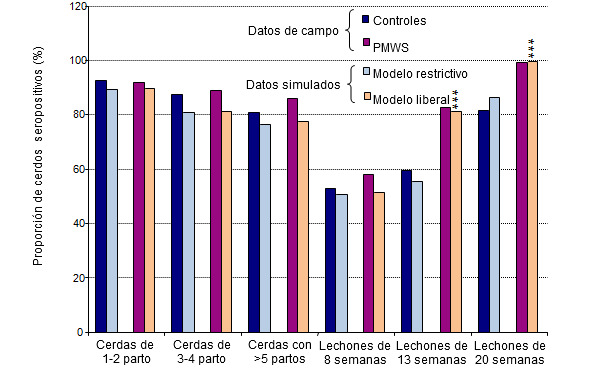
Figura 3. Comparación de resultados (seroprevalencia de PCV2) del modelo de simulación con los datos de campo.
Al evaluar las estrategias de vacunación, los resultados de la simulación indicaron que las vacunas para lechones reducían enormemente el número de infecciones. Esto implica un potente efecto protector de la vacunación que comporta un descenso dramático del número de infecciones por PCV2 en la transición y el engorde. Por tanto, al proporcionar una considerable reducción de infecciones tempranas por PCV2, estos resultados podrían explicar la gran eficacia documentada de las vacunas frente a la presentación clínica del PMWS al controlar la causa principal de un modo tan eficaz.
Mediante este ejemplo de PCV2, la modelización se muestra como una potente herramienta para entender una enfermedad compleja debido a una dinámica de infección específica del patógeno involucrado. Cuando se construyen adecuadamente, con una estimación cuidadosa de los parámetros, los estudios de modelización son extremadamente útiles parar entender los mecanismos biológicos, evaluar escenarios y sugerir nuevas investigaciones.
