El papel de la genética en la respuesta de los cerdos a la infección por PRRSV
07-ene-2014 (hace 11 años 2 meses 26 días)
Con la colaboración de Joan Lunney (ARS USDA) y Jack Dekkers (Iowa State University), el PRRS Host Genetics Consortium (PHGC) se estableció para incorporar herramientas genéticas y genómicas para minimizar el impacto del PRRS. El objetivo es combinar las tecnologías de última generación en virología-immunología y en genética-genómica. La prestación principal es la aplicación de los resultados en programas comerciales de reproducción. Los intentos previos de identificar genes que proporcionasen resistencia a enfermedades se habían centrado en comparar la respuesta a la enfermedad en cerdos de distintas líneas puras. El PHGC no hace comparaciones entre razas, sino que se centra en la identificación de marcadores de resistencia/susceptibilidad que están presentes en las poblaciones de animales comerciales que muestran diversos fenotipos de enfermedad.
Siguiendo este modelo, se infectaron experimentalmente 200 lechones con cepas bien caracterizadas de virus PRRS. Se recogieron datos individuales sobre el fenotipo de la enfermedad: mortalidad, carga viral en suero, GMD, valores de anticuerpos neutralizantes y de citoquina sérica (ver figura 1). El genotipado de todos los cerdos con el chip porcino 60K SNP y la realización de amplios estudios de asociación genómica ha servido para identificar varios marcadores relacionados con la progresión de la enfermedad clínica y su resistencia. El alelo favorable en un marcador importante en el cromosoma 4 del cerdo (Sus scrofa chromosome 4, SSC4) se asocia con un aumento de la GMD y una disminución de la carga viral. Durante los 42 días de la infección experimental, los cerdos con el genotipo favorable ganaron el 10 % más de peso y mostraron una reducción de la viremia. El efecto del genotipo beneficioso está modelado en la figura 2. Los resultados hasta la fecha indican que un beneficio similar del alelo favorable puede conseguirse en condiciones de campo.
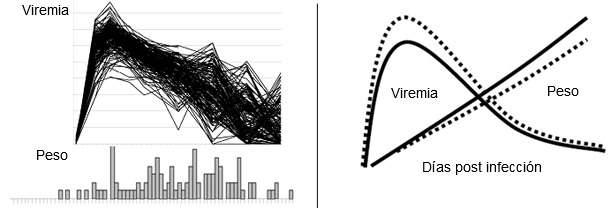
| Fig.1. Fenotipos de enfermedad por PRRSV a nivel poblacional. Las figuras muestran la viremia de PRRSV (figura superior) y la distribución de la GMD (inferior) en 200 cerdos infectados experimentalmente con PRRSV. Los cerdos se infectaron experimentalmente a las 3 semanas de vida y los datos se recogieron a los 42 días tras la infección. | Fig. 2. El efecto favorable del marcador beneficioso en SSC4 en GMD y en viremia en cerdos jóvenes. El modelo superior muestra las mejoras esperadas en GMD y viremia en cerdos con el alelo faborable (AB o BB, línea sólida) frente a cerdos con el genotipo AA (línea de puntos).El aumento en la GMD es aproximadamente del 10 %. La disminución del pico de viremia es de aproximadamente de 1 log. |
Se detectaron resultados fenotípicos adicionales que estaban relacionados con varios aspectos de la inmunidad específica frente a PRRSV. Por ejemplo, identificamos una relación inversa entre la carga viral y los títulos neutralizantes frente al virus. Además, un pequeño porcentaje de cerdos infectados produjo una respuesta de anticuerpos única, que pueden ser identificados como ampliamente neutralizantes y que tenía la capacidad de neutralizar una amplia gama de cepas, incluyendo los virus tipo I. Pese a que no se ha detectado un componente hereditario para la respuesta inmunitaria, el nivel de anticuerpos anti-proteínas N sí que tenía un componente heredable específico, relacionado con un SNP en SSC7. Un marcador en SSC1 está correlacionado con varios problemas respiratorios en cerdos con CRP. El marcador genético más próximo está cerca de un receptor de citoquinas inflamatorias.
Los resultados del trabajo llevado a cabo por el PHGC ilustran hallazgos importantes. En primer lugar, la enfermedad clínica y las consecuencias de la infección por PRRS tienen un componente hereditario significativo. En segundo lugar, hay un número relativamente pequeño de marcadores genómicos asociados a un determinado fenotipo de enfermedad. Esto hace posible incorporar selección asistida por marcadores para producir cerdos con una mejor respuesta a la infección. Y, finalmente, de momento todos los marcadores genómicos relacionados con la enfermedad clínica y la inmunidad se encuentran en regiones del genoma porcino con genes inmunológicamente relevantes, incluyendo genes estimulados por interferón, genes CMH y genes que responden a la citoquina.
En conclusión, la genómica y la genética son herramientas para mejorar la salud animal, especialmente en las enfermedades infecciosas que carecen de vacunas o tratamientos efectivos. Cuando se combine la mejora genética con mejores vacunas y mejor nutrición, será posible revertir la mayoría de los efectos negativos del PRRS endémico.
