¿Es posible simplificar la congelación del semen porcino?
22-jul-2013 (hace 11 años 8 meses 11 días)
Hoy, pese a los esfuerzos documentados para alcanzar una fertilidad y prolificidad aceptables tras la IA, la criosupervivencia de los espermatozoides porcinos sigue siendo baja, debida a los daños producidos durante un procesado relativamente anticuado que resulta lento (8-9 h), caro (necesita centrifugadoras refrigeradas, etc) y que produce pocas dosis por eyaculado (a menudo sólo para 5-8 cerdas con 2 IA/celo). El número de lechones nacidos sigue siendo más bajo que con semen refrigerado o puro, implicando que la vida útil de los espermatozoides, el sitio de deposición y la cercanía a la ovulación conspiran contra el éxito del proceso. Todo esto hace que el semen congelado no sea una alternativa en la producción porcina, aunque es necesario para los bancos de genes y la exportación. Este artículo presenta un proceso alternativo basado en las características in vivo del eyaculado, usando la primera porción de la fracción espermática del verraco, apenas 10 ml, para congelar pequeñas dosis (de 0,5 ml cada una), mientras que el resto de los espermatozoides eyaculados (más del 75%) se usan para la producción rutinaria de dosis líquidas, combinando de este modo la producción y el almacenaje. La fertilidad/prolificidad de estas pequeñas dosis congeladas/descongeladas es aceptable si se utiliza IA intrauterina profunda durante un celo espontáneo.
Aprendiendo del eyaculado
El eyaculado porcino consta de 3 fracciones que pueden diferenciarse visualmente durante la recogida manual: fracción preespermática (acuosa, con algunos coágulos gelatinosos, sin espermatozoides y de unos 10-20 ml), la fracción espermática (más densa, con espermatozoides, sin coágulos, de 30-50 ml) y la postespermática (otra vez acuosa, con coágulos y de 150-200 ml). Nuestros estudios han mostrado que los espermatozoides contenidos en los primeros 10 ml de la fracción espermática (también llamada pico espermático, que contiene el 15-20% de todos los espermatozoides, Fig 1) es más resistente al manejo (desde la dilución hasta la refrigeración) y la criopreservación que el resto de espermatozoides del eyaculado. Se considera que el hecho de que los primeros espermatozoides estén acompañados por una secreción específica (epidídimo/próstata), que contiene proteínas asociadas a la fertilidad, explica la mayor resistencia al manejo.
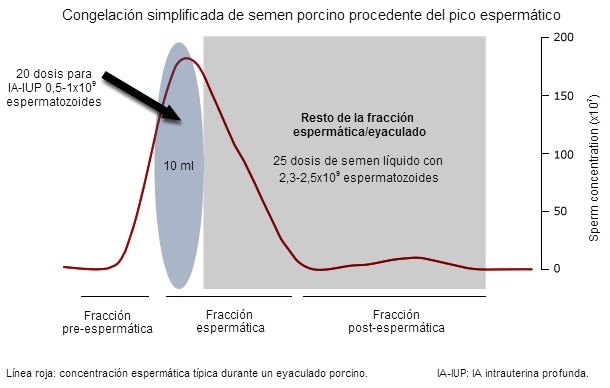
Figura 1: Un típico eyaculado de verraco presenta 3 fracciones distintas dependiendo –entre otros parámetros– de la concentración espermática (representada aquí con una línea roja). El pico espermático suele estar contenido en los primeros 10 ml de la fracción espermática. Si se congela, el pico espermático puede producir 20 dosis para IA intrauterina profunda, mientras que el resto del eyaculado (la fracción espermática) todavía puede producir unas 25 dosis seminales líquidas para IA convencional.
¿Podemos simplificar el protocolo de congelación?
Normalmente la congelación utiliza toda la fracción espermática eliminando, por dilución y centrifugación en centrífugas refrigeradas, el plasma seminal. Entonces los espermatozoides del sedimento se diluyen de nuevo, se refrigeran y se congelan, a menudo en pajuelas medianas (2,5 ml) o Flat-bags de 5 ml (Fig 2). Las dosis de IA suelen contener 5.000x106 espermatozoides, por lo que un eyaculado produce un máximo de 16 dosis para IA cervical (o sea, 8 cerdas a 2 IA/celo). Hemos comparado semen congelado de la fracción espermática (control) con el del pico espermático (los primeros 10 ml de la fracción espermática) utilizando congelación convencional (CC) frente a un proceso simplificado (CS). El semen del pico espermático se manejó en forma concentrada (900x106 espermatozoides/dosis) para un eventual uso en IA intrauterina profunda (1-2 dosis por celo, suficiente para 10 cerdas). Las células del pico espermático se mantenían durante 30 minutos en su propio plasma seminal y después, sin centrifugación (es decir, sin extraer el plasma seminal), se diluyeron con lactosa-yema de huevo (LEY, por sus siglas en inglés) y, durante 1,5 h, se refrigeraron hasta alcanzar los + 5°C, antes de ser mezcladas con LEY+glicerol (3%) y OEP (Orvus ES Paste, un detergente sintético) y se envasaron en Mini Flat-bags de 0,5 ml (Fig 2). La congelación utilizó en todos los casos una tasa de enfriamiento de 50°C/min. El proceso simplificado completo (CS) duró 3,5 h en comparación con la congelación convencional (CC) que duró 8 h; ambos tuvieron una criosupervivencia igualmente buena (más del 60% de las células procesadas).
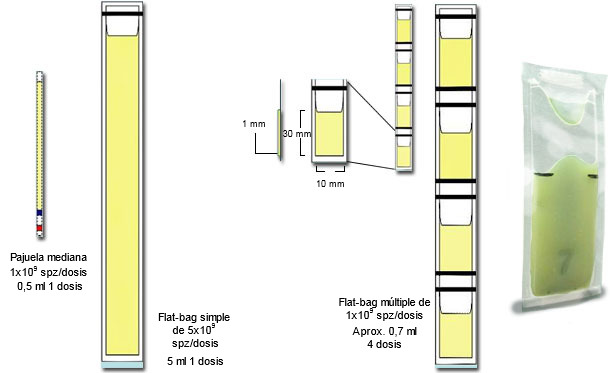
Figura 2: Representación esquemática de las principales diferencias entre las mini-pajuelas plásticas de 0,25 ml, con Flat-bags simples (5 ml) y múltiples (de 0,5-0,7 ml). A la derecha se presenta una fotografía de un Flat-bag llenado y sellado), cortesía del Dr Fernando Saravia).
¿Qué ventajas tiene?
Varias; utilizando este protocolo simplificado y más corto no es necesario el uso de centrífugas refrigeradas. Por otra parte, la variación intra-macho se minimiza utilizando espermatozoides de la primera porción (P1) que no sólo son los "mejores" para ser criopreservados sino que se utiliza la parte de la fracción espermática donde está documentado que se encuentran las proteínas asociadas a la fertilidad. Finalmente, este procedimiento libera el resto de los espermatozoides recogidos (75-80% del recuento total) para un procesado adicional de unas 25 dosis para IA convencional (Fig 1). Este protocolo simplificado debería ser una alternativa interesante en centros de inseminación para –usando el mismo eyaculado– congelar semen porcino para almacenaje, repoblación o distribución comercial y producir dosis para IA convencional con semen líquido, usando el resto del eyaculado. Este proceso no interfiere en la rutina de manejo de los verracos ni de sus eyaculados.
Pero, ¿Estas dosis tan pequeñas (0,5 ml, 500x106 espermatozoides) son fértiles?
Sí, aceptablemente fértiles, incluso tras una única IA intrautrina profunda en un celo espontáneo. Las inseminaciones intrauterinas profundas dobles (a las 24 y 36 h tras la detección del reflejo de inmovilidad) hecha en 120 cerdas (de segundo parto) con semen del pico espermático congelado como se ha descrito más arriba (CS), produjo 42 % de partos con 8 lechones vivos por camada. Las dosis complementarias de semen líquido (2,3 x 109 espermatozoides) produjo un 80% de partos, con 13 lechones vivos por camada (M Wallgren, resultados no publicados). Pese a no ser una alternativa frente al semen líquido para uso comercial, esta técnica de congelación es una buena opción para los bancos de genes y controles de bioseguridad sin interferir en la producción de dosis comerciales líquidas o en el manejo de los verracos.
