Enfermedad de Glässer: Patogénesis ¿porqué unas cepas si y otras no?
20-oct-2008 (hace 16 años 6 meses 5 días)
La identificación de Haemophilus parasuis como el agente responsable de la enfermedad de Glässer en lechones se realizó hace casi 100 años, pero desde entonces se ha avanzado relativamente poco en la identificación de los mecanismos que tiene esta bacteria para producir enfermedad.
Los estudios clínico-patológicos indican que esta bacteria debe tener mecanismos que le permitan colonizar el tracto respiratorio superior, alcanzar el pulmón y resistir a los mecanismos de defensa pulmonares. Posteriormente, tiene que ser capaz de invadir el torrente sanguíneo para llegar a distintos órganos del animal, donde se reproduce y finalmente causa la inflamación que da lugar a las características lesiones de poliserositis y artritis. Además, en algunos casos puede llegar a producir meningitis, lo que indica su capacidad de atravesar la barrera hematoencefálica. Por otro lado, también es sabido que hay animales portadores de H. parasuis que no desarrollan la enfermedad. Estas diferencias entre animales portadores y enfermos no se debe sólo a diferencias en el estado inmunológico de los animales, sino también a diferencias en la capacidad patogénica de las distintas cepas de esta bacteria.
Tabla 1. Aislamiento de Haemophilus parasuis de distintos órganos, tras inoculación de lechones vía nasal con una cepa aislada previamente de pericardio. (Adaptado de Vahle et al., 1995 J Vet Diagn Invest. 7:476-80 y Vahle et al., 1997 Can J Vet Res 61:200-6)
|
Órganos que se procesaron para aislamiento de Haemophilus parasuis
|
||||||||||||
|
Horas
p.i. * |
Nariz
|
Tonsila
|
Tráquea
|
Pulmón
|
Sangre
|
Pericardio
|
Pleura
|
Peritoneo
|
Articulación
|
Meninge
|
Hígado
|
Bazo
|
|
4
|
++
|
-
|
+
|
-
|
-
|
|
|
|
|
|
|
|
|
8
|
++
|
-
|
+
|
-
|
-
|
|
|
|
|
|
|
|
|
12
|
++
|
-
|
+
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
18
|
++
|
-
|
++
|
-
|
-
|
|
|
|
|
|
|
|
|
26
|
++
|
-
|
++
|
++
|
-
|
|
|
|
|
|
|
|
|
36
|
++
|
-
|
+
|
+
|
++
|
-
|
+
|
+
|
+
|
-
|
+
|
+
|
|
84
|
+
|
-
|
+
|
-
|
-
|
-
|
+
|
+
|
++
|
+
|
-
|
-
|
|
108
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
++
|
-
|
-
|
-
|
| *p.i.: post-inoculación | ||||||||||||
La existencia de cepas de H. parasuis con distinta capacidad patógena se demostró en infecciones experimentales con animales que carecían de anticuerpos frente a la bacteria. Estos animales se pueden obtener por cesárea o por parto natural, pero en ambos casos se priva a los lechones de tomar calostro y se les proporciona una alimentación sustitutiva carente de anticuerpos. Así, varios autores han observado que existen cepas capaces de reproducir el cuadro característico de la enfermedad de Glässer y otras cepas, en cambio, que son inocuas para los animales, incluso inoculadas por vía intraperitoneal.
Los factores de virulencia permiten a las cepas patógenas sobrevivir dentro del animal y causar la infección, mientras que las cepas no virulentas carecen de estos factores y sólo pueden sobrevivir en el tracto respiratorio superior como colonizadoras. Con el fin de identificar los factores de virulencia de H. parasuis, recientemente se han realizado diversos estudios genéticos y funcionales.
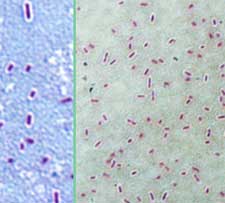 |
|
Figura 1. Tinción de Maneval de la cepa virulenta Nagasaki, mostrando la cápsula como un halo blanco alrededor de la bacteria. La cápsula podría ser responsable de la resistencia al suero y a la fagocitosis en cepas virulentas de Haemophilus parasuis.
|
Aunque se han ensayado distintos métodos genéticos con H. parasuis, hasta el momento no se ha demostrado la implicación de ningún gen específico en la virulencia de H. parasuis. Por su lado, los estudios funcionales han identificado varios mecanismos de virulencia. Estos estudios se basan en la comparación entre cepas virulentas y no virulentas en ensayos in vitro que pretenden simular condiciones a las que se enfrenta la bacteria durante la infección. Hasta el momento sabemos que las cepas virulentas de H. parasuis son resistentes a la fagocitosis de los macrófagos alveolares in vitro, son capaces de invadir células de endotelio en cultivo y son resistentes a la acción bactericida del suero (o lo que es lo mismo; resistentes al complemento). Estas facultades les permitirán sobrevivir en el pulmón del animal, atravesar los vasos sanguíneos y, posiblemente, la barrera hematoencefálica, y sobrevivir en el torrente sanguíneo hasta alcanzar otros órganos. Al contrario, las cepas no virulentas mueren en presencia de suero, son destruidas por los macrófagos pulmonares y no son capaces de invadir los endotelios de forma eficaz.
Estudios actuales se centran en la identificación de las moléculas responsables de estas funciones. Esto permitirá el diseño de técnicas de diagnóstico que diferencien cepas virulentas y no virulentas (colonizadoras) y ayudará a mejorar las estrategias de control de la enfermedad, en especial en el diseño de vacunas que eliminen de forma específica las cepas virulentas.
