Caso clínico: App
30-jun-2022 (hace 2 años 8 meses 27 días)
Una granja de 1000 cerdas en ciclo cerrado, situada en un ecosistema desértico, se transformó en una granja de 1500 reproductoras con producción de lechón al destete y reposición interna. La granja se llenó con cerdas de reposición procedentes de un alto origen sanitario, libre del vPRRS, Mycoplasma hyopneumoniae (M.hyo), Actinobacillus pleuropneumoniae (App) y diarrea epidémica porcina (DEP), entre otras enfermedades importantes en producción porcina.
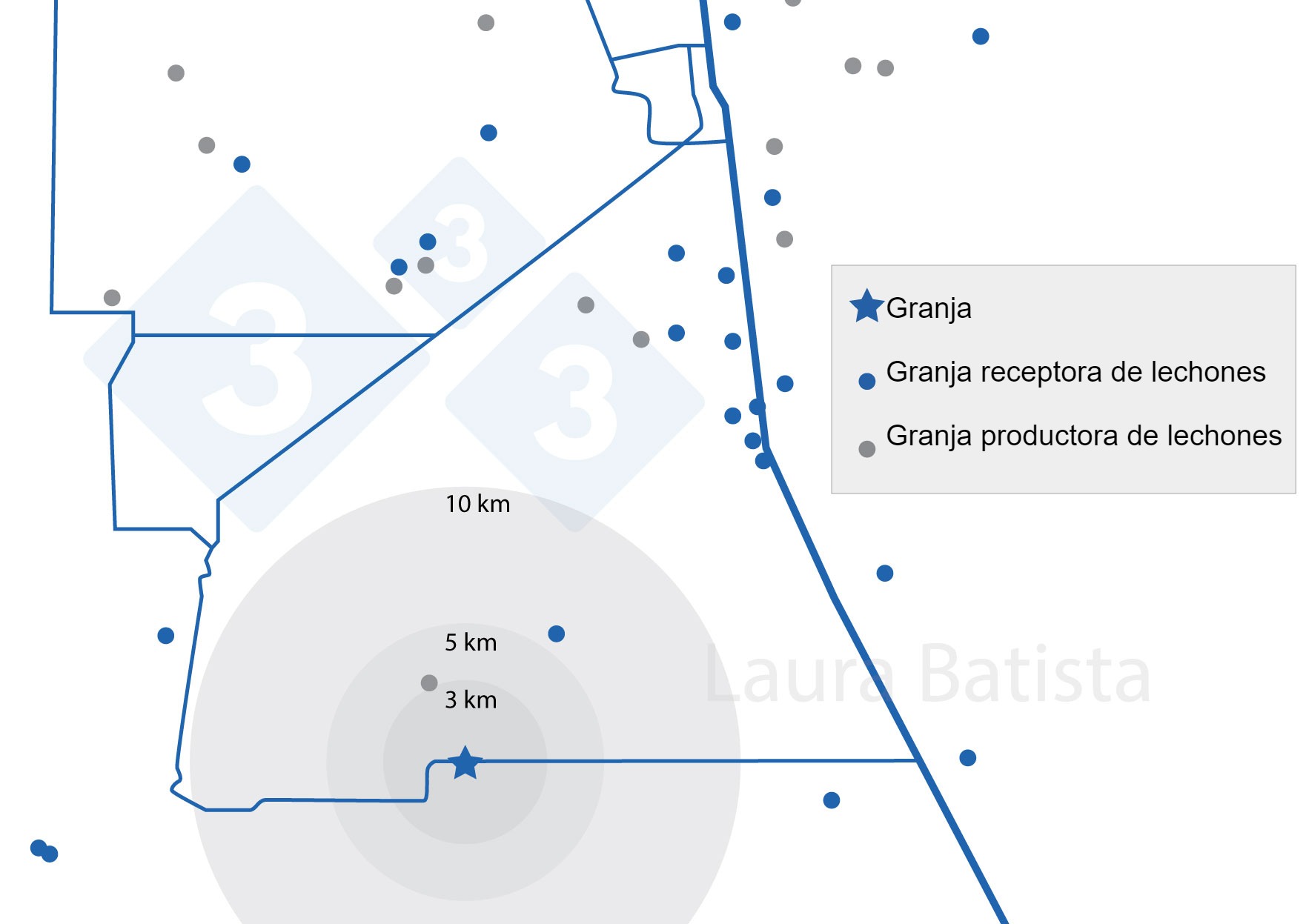
Se implementaron medidas y protocolos de bioseguridad que se creyeron eficaces para proteger el estado sanitario de la granja, ya que estaba situada a 500 metros de una carretera de alto flujo de transporte de cerdos y en una zona de alta densidad de producción porcina y de recepción de lechones. Es importante comentar que, en ese momento las estaciones de transferencia de alimento y traslado de animales no se consideraron procedimientos importantes para romper la cadena de transmisión de patógenos.






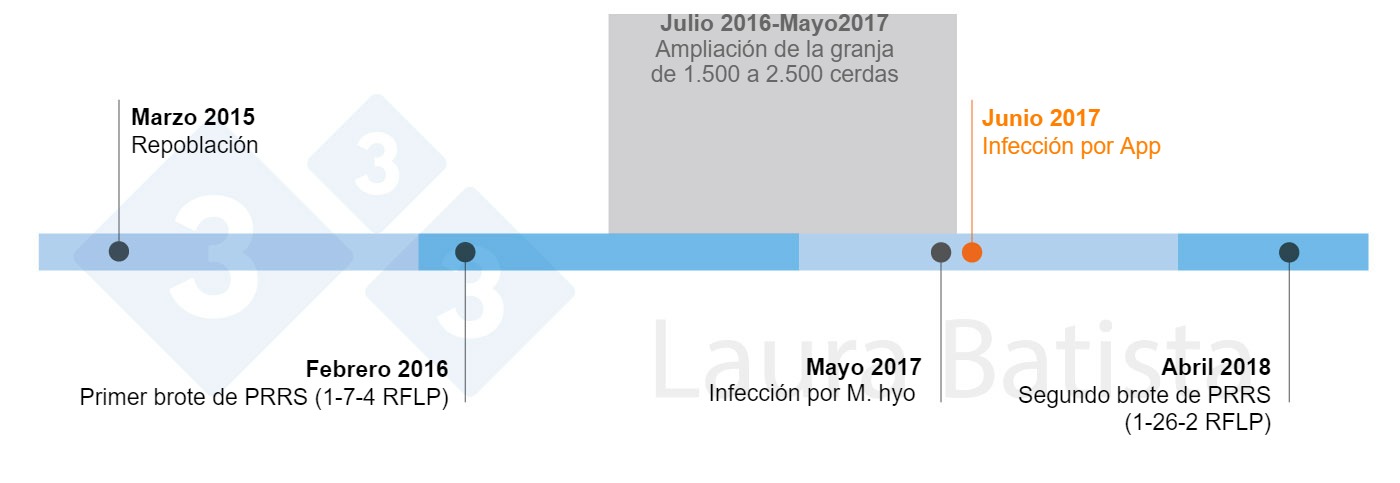
Las futuras cerditas de reposición, aproximadamente lotes de 60 lechonas cada 3 semanas, se trasladaban a la nave de reposición interna, mientras que el resto de lechones se transportaban cada semana a sitios 2 y 3 externos del mismo sistema productivo. Once meses después de llenar la granja, esta se infectó con la cepa del virus PRRS 1-7-4 RFLP. La granja se estabilizó mediante una única inoculación de virus vivo homólogo a todos los animales reproductores y de reposición. Cinco meses después, debido a la capacidad adicional de la granja, se aumentó el censo con animales de la reposición interna hasta un total de 2500 cerdas. Esta iniciativa resultó a una distribución de la paridad hacia la izquierda (con un censo más jóven), y en consecuencia, las cerditas de la reposición interna tenían una inmunidad menos robusta.
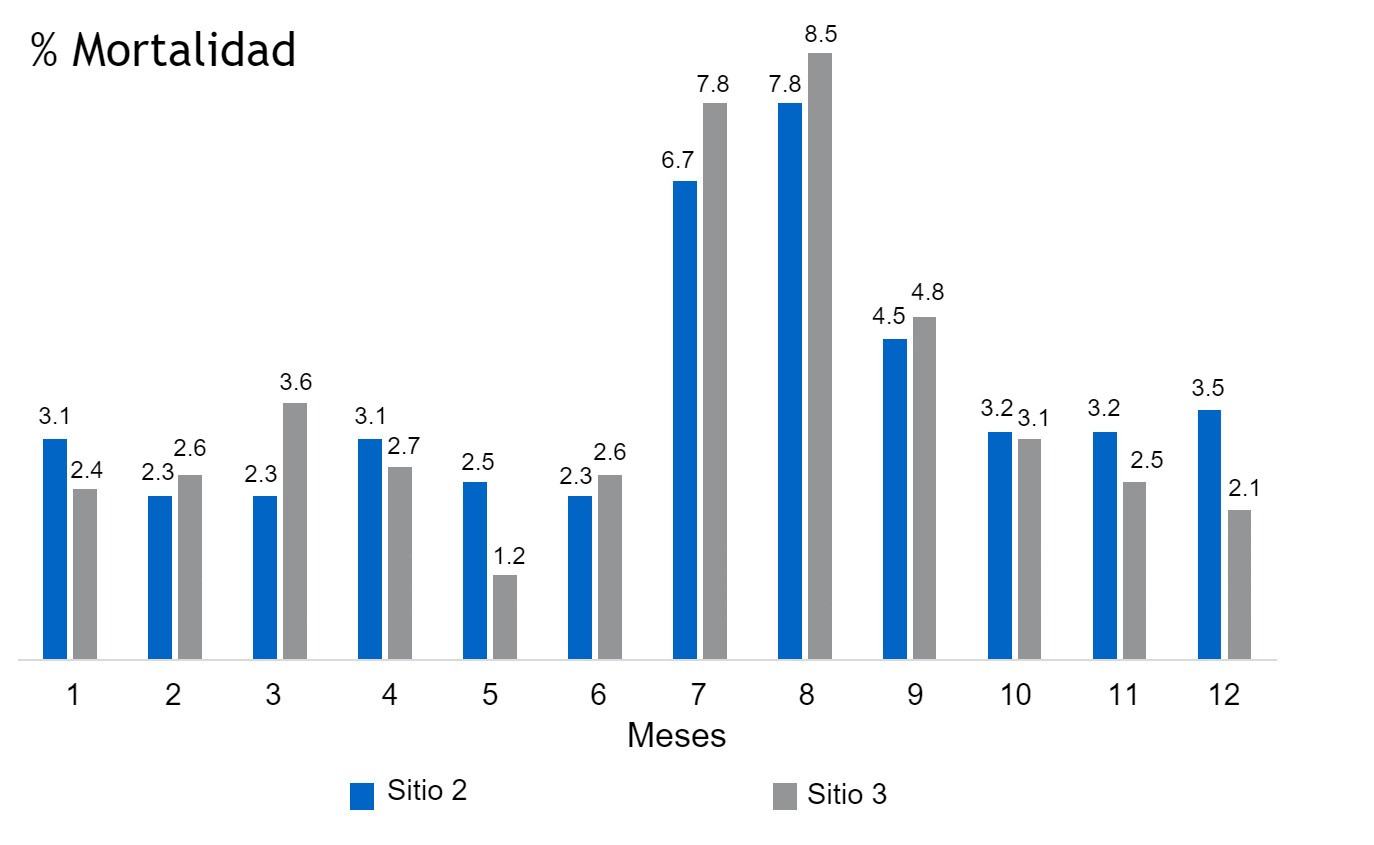
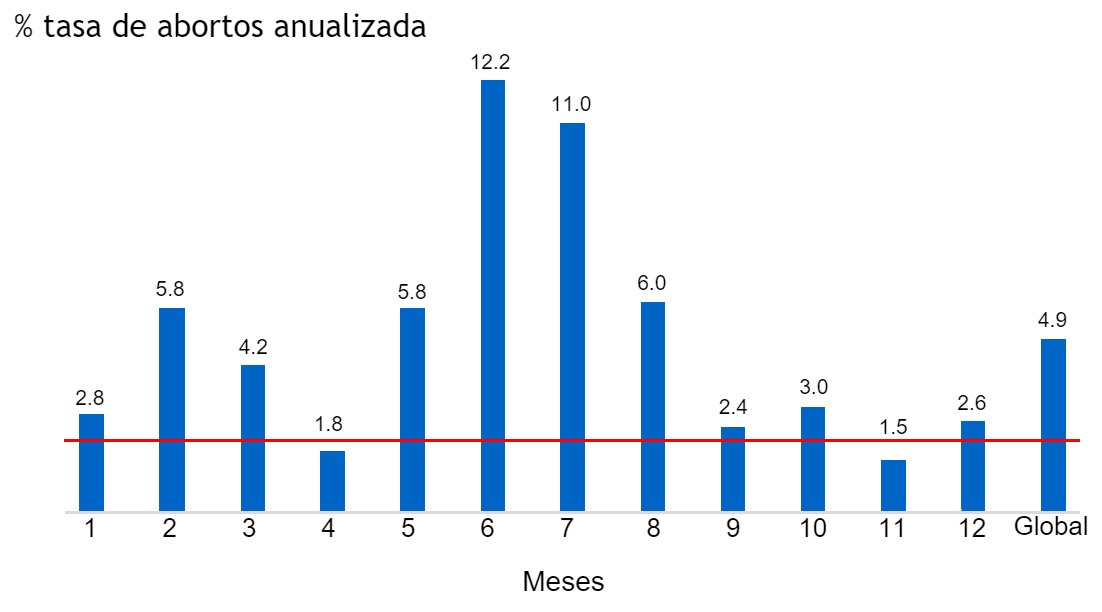
Dos meses después, aparecieron de manera repentina signos clínicos y lesiones características de App en las naves de reproductoras y engorde. Los signos clínicos se diseminaron rápidamente por otras naves y la mortalidad aumentó con rapidez, con animales presentando una característica descarga nasal espumosa y sanguinolenta. En la necropsia se observó pleuritis aguda y bronconeumonía necrotizante grave. Los principales signos clínicos fueron anorexia, depresión, fiebre, tos, disnea y vómitos. Además, la mortalidad y la tasa de abortos aumentaron en las últimas semanas de gestación. El brote duró 12 semanas.
En la semana de inicio del brote se envió al laboratorio de diagnóstico un extenso conjunto de tejidos que incluía pulmones, muestras de nódulos linfáticos y sangre. Los hallazgos macro e histopatológicos eran típicos de una pleuroneumonía aguda causada por App, reforzando su papel como el principal patógeno etiológico del brote. Sin embargo, los resultados serológicos indujeron a error, ya que todas las muestras fueron negativas a App-APX IV, y positivas tanto a M. hyo como a 1-7-4 RFLP y PRRSv PCR. Teniendo en cuenta que muchos estudios demuestran que las coinfecciones con diferentes agentes respiratorios son comunes en los cerdos y que las infecciones víricas predisponen a las infecciones bacterianas secundarias, y que se pensó que esta granja era negativa a App, el veterinario a cargo del problema concluyó que los signos clínicos se debían a una combinación de contaminación lateral por M. hyo y una desestabilización del PRRS en la granja y decidió volver a estabilizar la granja con una reinoculación de virus PRRS.
Una semana más tarde se aisló un organismo fenotípicamente similar a App a partir del tejido pulmonar y tres semanas más tarde se reportaron los serotipos 1 y 7. Lógicamente, la inoculación del vPRRS agravó el brote de App, como se muestra en las imágenes (Figuras 2 y 3).
Plan de acción
- Cerdas
- Medicación
- Control inmediato de los signos clínicos: inyección intramuscular de tulatromicina (2,5 mg/kg de peso vivo)
- Alimento medicado (tilmicosina a 363 g/tonelada) durante 3 semanas mientras se desarrollaba la inmunidad frente a la bacterina para App con los serotipos 1 y 7.
- Medicación
- Reproductoras y animales de engorde, vacunación con bacterina para App incluyendo los serotipos 1 y 7.
- A todas las reproductoras y el remplazo presente en la unidad de reposición interna. Esta táctica permite el control y evita la interferencia con la inmunidad maternal.
- Para neutralizar la toxina y evitar las lesiones, se vacunaron todos los lechones destetados con una vacuna que contenían anticuerpos frente la proteína de la membrana externa (OMP) y tres toxoides (APX I, APX II y APX III detoxificados) producidos por las cepas de App hasta se consiga la inmunidad maternal en las reproductoras.
Hipótesis de vías de entrada de patógenos
- Fallos de bioseguridad relacionado con las tareas de construcción (personal y equipo)
- Transporte contaminado, incluidos los camiones de aliemento y del personal de construcción
- Granjas vecinas
- Transporte en la ruta cercana de cerdos excretando.
- Transporte contaminado del mismo sistema
- Visitantes nocturnos indeseados
- Transmisión por aerosoles
Lecciones aprendidas
a) Diagnóstico
- Es esencial conocer el estado sanitario de la granja, especialmente antes de su ampliación.
- Asegurarse de enviar las muestras adecuadas y
- Realizar la prueba de diagnóstico de referencia
- En el caso de duda, realiza varias pruebas de diagnóstico antes de tomar cualquier decisión.
- Para establecer el estado frente a App en la granja, las pruebas deben incluir la identificación de anticuerpos contra diferentes antígenos bacterianos, el aislamiento del agente etiológico y la detección de ADN especifico por PCR.
- La inoculación del virus del PRRS es una herramienta eficaz, sin embargo, sólo debe utilizarse para generar inmunidad en las cerdas de recría sanas, durante la aclimatación y en una unidad biosegura y aislada.
b) Bioseguridad
Nunca subestimar la importancia de:
- Siempre auditar y supervisar la entrada de personal externo.
- Nunca subestimar la importancia de la localización de la granja.
- El transporte debe ser considerado como una vía de transmisión de patógenos.
- Se recomiendan auditorías de bioseguridad independientes para todas las granjas.
