Los productos comerciales para medicar el agua de bebida deben reunir unas condiciones de calidad, seguridad y eficacia durante todo el período de vida útil, tanto en condiciones de almacenamiento como en su utilización, donde la estabilidad es crítica. Las pruebas de estabilidad juegan un papel fundamental para el desarrollo final de un producto. Estas pruebas se realizan con estándares de calidad EMEA (European Medicines Agency) y CVMP (Committee for Medicinal Products for Veterinary Use) basados en simular las condiciones reales en granja.
El producto comercial está formado por una combinación de principio/s activo/s y excipiente/s.
- El principio activo es el compuesto con actividad terapéutica.
- El excipiente es el agregado/s que transformaran al principio/s activo/s en un combinado apto para su administración.
Su estabilidad dependerá en primer lugar de la compatibilidad excipiente-principio activo: Los excipientes y algunas impurezas presentes pueden desestabilizar medicamentos. La degradación provoca inestabilidad, comporta pérdida de potencia de la medicación, cambios indeseables en el rendimiento (disolución, biodisponibilidad, etc.) y los productos de degradación pueden causar toxicidad.

En estado “sólido” se producen reacciones químicas debidas al bajo ratio principio activo/excipiente, cambios en las partículas (forma, tamaño, impurezas y defectos) y efecto del ambiente (Tª, HR, luz y oxígeno). En “solución” son la Tª, pH, ratio solvente/diluyente, luz, oxígeno y co-solutos (sales tampón, agentes antioxidantes, agentes quelantes, etc.) los responsables de la degradación.
Tabla 1. Ejemplos de degradación. Fuente: Crowley y Martini, 2001.
| Ejemplos de degradación | ||||
|---|---|---|---|---|
| Hidrólisis | Oxidación | Isomerización | Fotólisis | Polimerización |
| Penicilinas | Ácido ascórbico | Tetraciclina | Ácido fólico | Ampicilina |
La estabilidad de los distintos productos se comprueba mediante la aplicación de diversas pruebas de estabilidad.
1. Estabilidad probada del producto comercial:
El objetivo de las “pruebas de estabilidad” es evaluar la calidad de las sustancias añadidas que forman el producto comercial y recomendar las condiciones de almacenamiento y uso.
Un preparado se considera estable si el principio activo mantiene su potencia especificada desde la fecha de fabricación hasta administración final al animal.
El “test de stress” ayuda a determinar la estabilidad intrínseca de la molécula identificando los productos de degradación mediante procedimientos analíticos. Hablamos de “pruebas de estabilidad a largo plazo” para monitorizar las características físicas, químicas y microbiológicas durante el período de vida útil del producto en el mismo envase que se propone circular en el mercado y “pruebas de estabilidad aceleradas” diseñadas para lograr el incremento de la velocidad de degradación química o física de un producto en condiciones extremas o exageradas de su envase original.
| Tipo de prueba | Condiciones de almacenamiento | Período mínimo |
|---|---|---|
| Estabilidad a largo plazo | 25ºC ±2ºC / 60%HR ±5% | 6-12 meses |
| Estabilidad acelerada | 40ºC ±2ºC / 75%HR ±5% | 6 meses |
Se han desarrollado sistemas de laboratorio para estudios de degradación de productos farmacéuticos simulando distintas condiciones de campo.
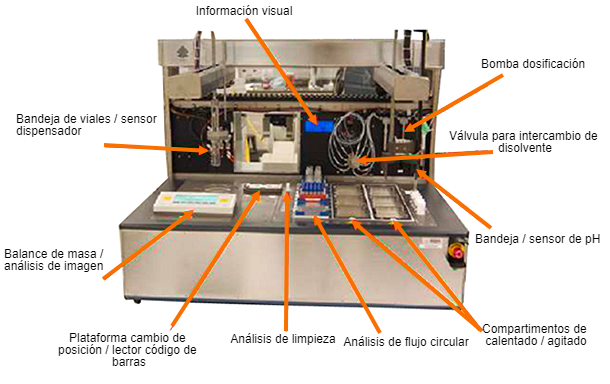
2. Pruebas de estabilidad en almacenamiento y transporte:
El objetivo es identificar las condiciones ambientales que dan estabilidad al producto desde la fabricación hasta la administración al animal teniendo en cuenta la fecha de caducidad basada en: análisis, Tª de almacenamiento recomendada, exposición a factores ambientales (Tª extremas, luz, humedad, etc.) y otras restricciones especiales que deben reflejarse en la etiqueta.

3. Pruebas de estabilidad en envase cerrado del producto:
El objetivo es mantener el producto comercial con un % bajo de impurezas y con sus características físico-químicas y microbiológicas constantes. El envase debe proteger el producto para impedir reacciones adversas debidas a factores externos.
4. Pruebas de estabilidad en uso del producto:
El objetivo es comprobar cuanto tiempo se mantiene el producto estable una vez abierto el envase.


5. Pruebas de estabilidad en agua de bebida:
Las distintas calidades de agua que se pueden encontrar en las granjas hacen este tipo de pruebas verdaderamente importantes. En el agua pueden darse variaciones físico-químicas, microbiológicas y de pH. Se debe comprobar la estabilidad y solubilidad del producto en todo tipo de aguas y temperaturas, simulando situaciones reales (ver artículo). Se analizan muestras de agua medicada a diferentes intervalos de tiempo comprobando la concentración del principio activo en aguas duras (pH 8-9) y blandas (pH 5-7), y a diferente temperatura. Hay que precisar cuál es la solubilidad máxima del producto cuando la concentración es varias veces superior a la utilizada a nivel de campo. La turbidez como reducción de la transparencia debido a la presencia de partículas en suspensión se medirá y expresará en unidades NTU (Nephelometric Turbidity Units). La fracción insoluble puede medirse mediante filtración de la disolución, secado y peso final del residuo. Debe comprobarse además que la presencia de cloro en el agua no implique fenómenos que actúan negativamente sobre la estabilidad de la molécula.


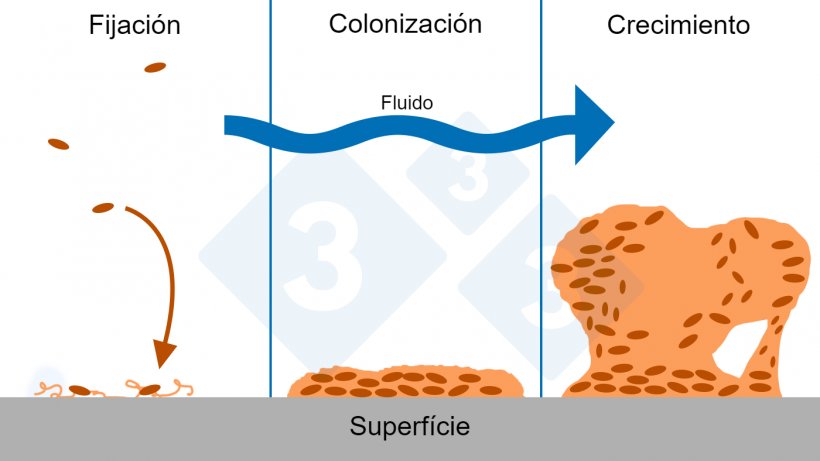
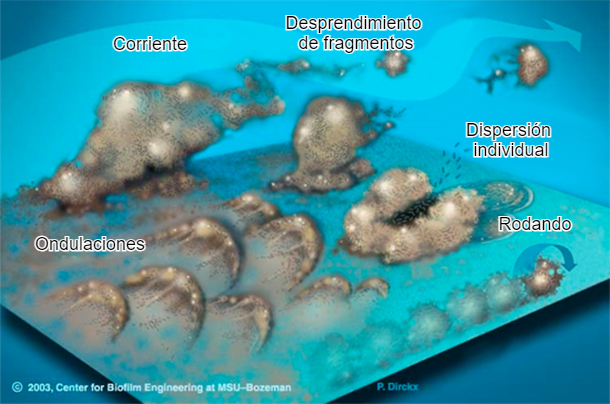
6. Pruebas de estabilidad en biofilm
El biofilm son comunidades complejas de microorganismos resistentes a antibióticos, recubiertas de un polímero extracelular que les ayuda a retener el alimento y a protegerse de agentes tóxicos. La presencia del biofilm en las conducciones de agua es frecuente, debido a una deficiente aplicación de métodos de higienización y puede afectar la estabilidad de las medicaciones. La prueba de estabilidad puede realizarse mediante un antibiograma de estos microorganismos junto con una muestra del producto a utilizar y observar el resultado: si hay un crecimiento microbiano masivo, no hay inhibición mientras que si lo afecta su estabilidad estará comprometida.
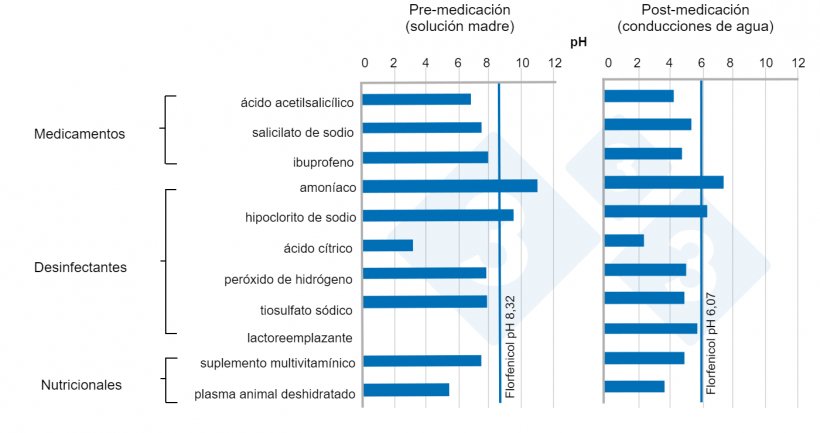
7. Pruebas de estabilidad en almacenamiento máximo del agua medicada:
Almacenamientos prolongados pueden afectar la calidad de la medicación (palatabilidad y contaminación). Este período debería corresponder al tiempo máximo durante el cual el concentrado sigue siendo eficaz y seguro (fecha de caducidad). Los factores asociados a productos poco estables en agua se traducen en escasa biodisponibilidad, incapacidad para optimizar los componentes activos en base de eficacia y seguridad, ausencia de respuesta proporcional a la dosis, dosificaciones subóptimas y precipitación incontrolable después de la dosificación, entre otras. Las interacciones entre productos disueltos en agua también deberían tenerse en cuenta. En la gráfica se muestra como se modifica el pH del agua al mezclar florfenicol con otras sustancias.