Descripción de la granja
Este artículo describe un caso clínico ocurrido en la reproducción de una explotación griega de ciclo cerrado. La capacidad de la granja era de 650 cerdas en producción (híbridas comerciales de Large White × Landrace) y tenía un núcleo de 35 abuelas para la producción de las F1 de reposición. Las cerdas destetadas y las de reposición se alojaban en jaulas individuales durante 30-35 días donde eran inseminadas artificialmente dos veces con semen fresco del mismo verraco. A los 30-35 días de gestación, las cerdas eran trasladadas a corrales donde se alojaban en grupo (10 animales/grupo). El esquema vacunal de las reproductoras y de los lechones destetados se muestra en la tabla 1. El programa antiparasitario preventivo incluía una única inyección de ivermectina 14 días antes del parto, para las hembras, y dos veces al año en el caso de los verracos.

La granja era seropositiva a PRRSv y, un año antes del presente caso, se produjo un brote en las reproductoras y en el engorde (según los resultados de la PCR, el 30% de las cerdas, el 90% de los destetados y el 35% de los cerdos de engorde fueron positivos).
Tabla 1. Protocolo vacunal de las reproductoras y los destetados.
| Vacuna | Protocolo |
| Nulíparas | |
| Virus de Aujeszky | 90º + 120º día de vida |
| Parvovirus + Erisipelas | 150º + 180º día de vida |
| Rinitis atrófica | 150º + 180º día de vida |
| PRRSv | 180º + 210º día de vida |
| Escherichia coli + Clostridium perfringens | 160º + 190º día de vida |
| Cerdas | |
| Virus de Aujeszky | 4 semanas antes del parto |
| Parvovirus + Erisipelas | 2 semanas después del parto |
| Rinitis atrófica | 3 semanas antes del parto |
| PRRSv | 60º día de gestación + 6º día de lactación |
| Escherichia coli + Clostridium perfringens | 2 semanas antes del parto |
| Verracos | |
| Virus de Aujeszky | 3 veces al año |
| Parvovirus + Erisipelas | 3 veces al año |
| Rinitis atrófica | 3 veces al año |
| Lechones | |
| Mycoplasma hyopneumoniae | 7º + 21º día de vida |
| Circovirus porcino tipo 2 | día del destete |
Aparición del caso
Se detectó un eritema multiforme (EM) en la mayoría (90%) de las cerdas, asociado con problemas respiratorios y sin mortalidad. Desde enero de 2014 hasta nuestra visita clínica en mayo de 2014, cuando se trasladaban las cerdas a los corrales donde se alojaban en grupos (~ 30-35 días de gestación), desarrollaban un EM, caracterizado por áreas cutáneas elevadas y enrojecidas repartidas por todo el cuerpo, especialmente en el cuello, la cara y alrededor de los ojos y orejas (figuras 1-3). Además, las cerdas enfermas presentaron depresión, anorexia, fiebre elevada durante 1-3 días (40 - 41,5ºC), dificultades posturales y signos respiratorios (dificultades respiratorias moderadas, descargas oculares y nasales con moco y sangre / figuras 4-5). Estos síntomas no se detectaron en las cerdas lactantes ni en las recién destetadas, o en la nave de las nulíparas de reposición que todavía no habían sido inseminadas. Los signos clínicos eran evidentes y duraban varias semanas en la mayoría (~ 90%) de cerdas gestantes una vez mezcladas en los corrales, así como en las cerdas/nulíparas del núcleo de abuelas. Por otra parte, entre el 10 y el 15% de las cerdas y nulíparas inseminadas repitieron el estro justo después de mezcarlas en los corrales (tabla 2).
Tabla 2. Parámetros reproductivos de la granja en 2014
| Parámetros reproductivos | Meses | |||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| Tasa de partos (%) | 72 | 68,7 | 71,4 | 73,8 | 74,9 | 78,1 | 77,3 | 67,4 | 76,3 | 85,0 | 92,5 | 94,2 |
| Abortos (%) | 1,9 | 2,2 | 2,4 | 2,1 | 2,0 | 1,8 | 1,6 | 1,5 | 1,1 | 0,5 | 0,4 | 0,2 |
| Repeticiones (%) | 26,0 | 29,0 | 26,0 | 24,0 | 23,0 | 20,0 | 21,0 | 31,0 | 22,5 | 14,4 | 7,0 | 5,5 |
| Cerdas vacías (%) | 0,1 | 0,1 | 0,2 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 |
| Nacidos vivos/camada | 13,2 | 13,2 | 13,1 | 13,2 | 13,2 | 13,1 | 13,3 | 13,1 | 13,2 | 12,9 | 13,1 | 13,1 |
| Destetados/cerda | 10,7 | 10,9 | 10,8 | 10,8 | 10,9 | 11,0 | 11,1 | 11,1 | 11,2 | 11,4 | 11,6 | 11,8 |


Figuras 1-2. Cerdas enfermas alojadas en grupo con EM, caracterizado por áreas rojas y elevadas por todo el cuerpo.
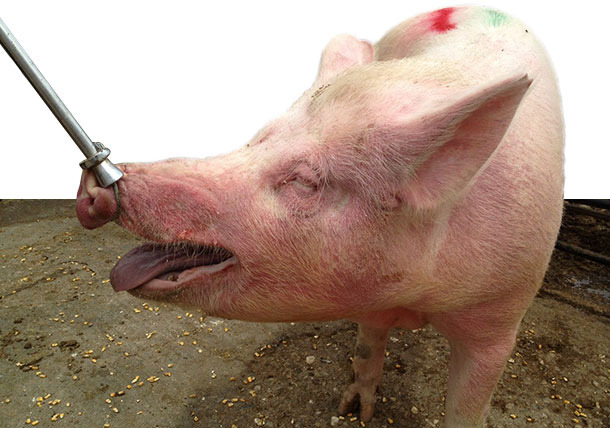
Figura 3. Cerda enferma alojada en grupo con EM, caracterizado por áreas rojas y elevadas en el cuello y la cara (especialmente alrededor de los ojos y orejas).

Figuras 4-5. Cerdas enfermas con EM y depresión, anorexia, fiebre, dificultades respiratorias moderadas, descargas nasales y oculares con moco y sangre.
Muestreo y examen diagnóstico
En mayo de 2014 se tomaron muestras de sangre de 7 cerdas enfermas, así como hisopos nasales y vaginales de otras 4 cerdas enfermas (las cerdas muestreadas estaban en el día 30-45 de gestación y su número de parto oscilaba entre 1 y 5). Además, en agosto de 2014 se recogieron muestras nasales de 7 cerdas enfermas.
Las muestras de suero sanguíneo se examinaron mediante: a) PCR cuantitativa (qPCR) para PRRSv (PRRSv tipo 1, o europeo, y PRRSv tipo 2, o norteamericano) y para PCV2, y b) ELISA para anticuerpos frente a Actinobacillus pleuropneumoniae (App), Erysipelothrix rhusiopathiae (Ery), PRRSv, ADV gE, virus de la peste porcina africana (PPAv), virus de la peste porcina clásica (PPCv), y Leptospira spp. Los hisopos nasales se examinaron mediante PCR para el gen apx-IV de App, Bordetella bronchiseptica, Haemophius parasuis, Pasteurella multocida, Streptococcus suis, Citomegalovirus porcino (PCMv, rinitis por cuerpos de inclusión) y virus de la Influenza porcina (SIV) (H1N1, H3N2, H1N2).
También se tomaron 2 muestras de sangre (con anticoagulante, y una estricta asepsia y equipo estéril) de cerdas enfermas para su cultivo en sangre. Se hicieron análisis hematológicos y bioquímicos de las muestras de sangre. En el matadero se tomaron muestras de 7 cerdas enfermas (piel, hígado, riñón y pulmón) para su examen macro y microscópico.
También se tomaron muestras del pienso de toda la gestación y lactación para buscar micotoxinas [aflatoxinas (B1, B2, G1, G2), deoxinivalenol (DΟN), acetildeoxinivalenol (acetil-DΟN), nivalenol, zearalenona (ΖEΝ)] mediante el método HPLC (Varian 9010 & 9050).
Resultados laboratoriales
Los resultados de ELISA y PCR en las muestras de suero se muestran en la tabla 3. Todas las cerdas fueron seropositivas a App y PRRSv, pero negativas a PPAv, PPCv, ADV y Leptospira spp. Además no se detectó viremia por PRRSv ni PCV2. Los resultados de los hisopos nasales se describen en la tabla 4. No se detectó B. bronchiseptica, P. multocida ni PCMv en ninguna muestra. S. suis se detectó en todas las muestras, mientras que una (nº 11) fue positiva a App, H. parasuis y S. suis. Una de las muestras tomadas en mayo de 2014 fue positiva a SIV.
Tabla 3. Resultados de los análisis de las muestras séricas de siete cerdas que presentaban lesiones cutáneas y síntomas respiratorios.
| Patógenos | Test | Nº de cerdos positivos / Nº de analizados | |
| Mayo 2014 | Agosto 2014 | ||
| Actinobacillus pleuropneumoniae | APX-IV ELISA | 7/7 | 4/7 |
| Erysipelas | ELISA | 0/7 | 0/7 |
| Virus PPA | ELISA | 0/7 | 0/7 |
| Virus PPC | ELISA | 0/7 | 0/7 |
| PCV2 | qPCR | 0/7 | 0/7 |
| PRRSv* | ELISA | 7/7 | 7/7 |
| PRRSv tipo 1 (UE) | PCR | 0/7 | 0/7 |
| PRRSv tipo 2 (EE.UU.) | PCR | 0/7 | 0/7 |
| Virus Aujeszky | gE Acs ELISA** | 0/7 | 0/7 |
| Leptospira spp. | ELISA | 0/7 | 0/7 |
*Resultados ELISA anticuerpos frente a PRRSv: < 0,4 negativo; 0,4-0,99 positivo 1; 1,0-1,49 positivo 2; 1,5-1,99 positivo 3; 2,0-2,49 positivo 4; 2,5-2,99 positivo 5; ≥ 3,0 positivo 6
** positivo: infectado con virus de campo (anticuerpos frente a AK gE) - negativo: no infectado con el virus de campo (sin anticuerpos frente a AK gE).
***L. Pomona, L. tarassovi, L. canicola, L. grippothyphosa, L. Bratislava: todas las muestras fueron < 1:100
Tabla 4. Resultados de las PCR de los hisopos nasales de cerdas enfermas.
| Nº de cerdos positivos / Nº de analizados | Patógenos | ||||||
| App | B. bronchiseptica | H. parasuis | P. multocida | PCMv | S. suis | SIV | |
| Mayo 2014 | 1/4 | 0/4 | 1/4 | 0/4 | 0/4 | 4/4 | 1/4 (H1N1) |
| Agosto 2014 | 1/7 | 0/7 | 6/7 | 0/7 | 0/7 | 7/7 | 0/7 |
El examen de los hisopos vaginales reveló infecciones por E. coli y Streptococcus spp. en todas las muestras. En los cultivos de sangre se aisló Streptococcus spp y Actinobacillus spp, mientras que el antibiograma reveló que eran sensibles a: penicilina, ampicilina y a la combinación amoxicilina + ácido clavulánico.
Los análisis hematológicos y bioquímicos indicaron una leucocitosis moderada con linfocitos atípicos y linfopenia (posiblemente secundaria a la depleción de los linfocitos CD4), anemia leve y trombocitopenia en un caso. En dos casos se detectó un recuento de eosinófilos superior a 3000/μL. En dos casos, un recuento total de glóbulos blancos muy elevado fue consistente con infección. El examen histopatológico de la piel reveló un aumento de la vascularización de la dermis, principalmente en las capas superficial y media (figura 6). No se encontraron lesiones destacables en los otros órganos analizados.
No se detectaron micotoxinas en los piensos de gestación ni de lactación.
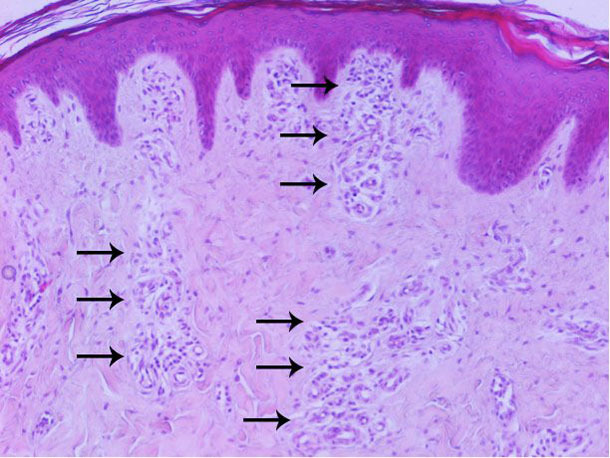
Figura 6. Análisis histopatológico de la piel: aumento de la vascularización principalmente en la dermis superficial y media.
Medidas tomadas
Para combatir la infección por E. coli y Streptococcus spp., en mayo de 2014 se inyectó amoxicilina + ácido clavulánico a todas las cerdas el día del destete mientras que, durante la primera semana de introducción de las cerdas/nulíparas al corral donde se alojaban en grupo, se les administraba 400 ppm de amoxicilina vía pienso. Además se añadió ácido acetilsalicílico en polvo al pienso durante 3 días en las cerdas enfermas. Finalmente, para reducir la agresión entre cerdas, se aplicó un producto comercial (basado en plantas), con sabor amargo, localmente en la piel alrededor del cuello y en la parte superior de la espalda.
En agosto de 2014, se incluyó la vacunación frente a SIV y H. parasuis en el protocolo vacunal rutinario para cerdas y nulíparas, y frente a App en el de las nulíparas de reemplazo. Dos meses después del inicio de las vacunaciones, los signos clínicos (EM, signos respiratorios, etc) disminuyeron drásticamente.
Evolución del caso / Conclusiones
El estrés afecta a la función inmunitaria, por tanto las infecciones son más probables en cerdos que se encuentran bajo la situación estresante de un alojamiento en grupo. Además, el estrés puede propiciar la activación de una infección subclínica. En el presente caso clínico, es posible que las cerdas/nulíparas inseminadas se vieran sujetas a un estrés en el momento en que su estatus inmunitario era más bajo, haciéndolas más susceptibles a infecciones y a desarrollar enfermedades. Se sabe que las mezclas y la densidad elevada pueden causar estrés, influenciando negativamente la función inmune. Como la EM es una reacción de hipersensibilidad que suele estar desencadenada por infecciones, o enfermedades, la posible explicación de la manifestación clínica de EM en este caso podría ser la fiebre (debida a las infecciones por S. suis, H. parasuis y App) y posiblemente el estrés (debido a la mezcla y a las peleas). La posibilidad de incluir la infección por SIV en la etiología es baja, ya que no se diseminó a otras cerdas y normalmente no debería haber afectado sólo a las cerdas tras mezclarlas en el grupo.
Actualmente, tras el control inicial de los signos clínicos y de la aplicación de las vacunaciones frente a SIV y H. parasuis, solemos ver algún caso esporádico y extremadamente leve, tanto en número como en severidad. Estos casos esporádicos se producen básicamente en nulíparas, tras ser inseminadas y mezcladas en el grupo (>30-35º día de gestación). El protocolo de tratamiento incluye dos inyecciones de amoxicilina + ácido clavulánico y meloxicam/48h. Alternativamente, se puede inyectar dos veces amoxicilina + ácido clavulánico/48h y añadir ácido acetilsalicílico en polvo al pienso durante 3 días.
En resumen, el estrés durante el alojamiento en grupos puede ser un factor desencadenante en este caso clínico, ya que parece activar una infección subclínica o una interacción con diferentes patógenos respiratorios, afectando negativamente la salud y el rendimiento de las cerdas.



