El estrés se define como un fenómeno biológico que consiste en la reacción de un organismo frente desafios físicos o mentales excesivos. El estrés activa el síndrome general de adaptación (SGA), caracterizado por una actividad hormonal específica y cambios patológicos. El principal signo de una reacción de estrés es un aumento de la producción de glicoesteroides de la corteza suprarrenal.
En la producción porcina intensiva, el estrés puede estar causado por diferentes alteraciones, como las relacionadas con la densidad excesiva de animales, los movimientos frecuentes o períodos largos de transporte, que alteran el equilibrio entre el entorno y los animales (Nawroth et al., 2019). Debido a las conexiones entre diversos mecanismos fisiológicos, el estrés puede afectar negativamente no sólo a la inmunidad y, en consecuencia, a la sanidad, sino sobre todo a la reproducción (Dobson et al., 2000).

Existen dos reacciones al estrés, dependiendo del comportamiento del individuo afectado: una reacción activa, que consiste en un ataque o huida, y una reacción pasiva, que consiste en la inmovilidad y la depresión durante el estrés de mayor duración (Henry y Stephens, 2013). El aumento de adrenalina y noradrenalina es característico de una reacción activa. Durante una reacción pasiva, se observa un aumento de los niveles de corticosteroides (Menash, 2013).
Efectos del estrés en la respuesta inmunitaria
Los mecanismos relacionados con el estrés que determinan el impacto en el sistema inmunitario aún no se entienden completamente. Sin embargo, se conoce la influencia mutua de los sistemas nervioso e inmunitario. Las principales vías implicadas en estas interacciones son el eje del sistema nervioso simpático (SNS) y el eje hipotalámico-pituitario-adrenal (HPA). Estos sistemas se comunican entre sí a través de dos ejes. En el eje SNS participan el sistema nervioso simpático y la médula suprarrenal. El sistema nervioso simpático forma parte del sistema nervioso autónomo, que activa los órganos internos y es responsable de la respuesta de lucha o huida (Tindle y Tadi, 2022).
La figura 1 ilustra la respuesta en un cerdo cuando se activa el sistema simpático por un estresor agudo. La activación del sistema simpático en cerdos puede medirse mediante la cromogranina A (CgA), que es una proteína soluble ácida perteneciente a la familia de las graninas (Escribano et al., 2013).
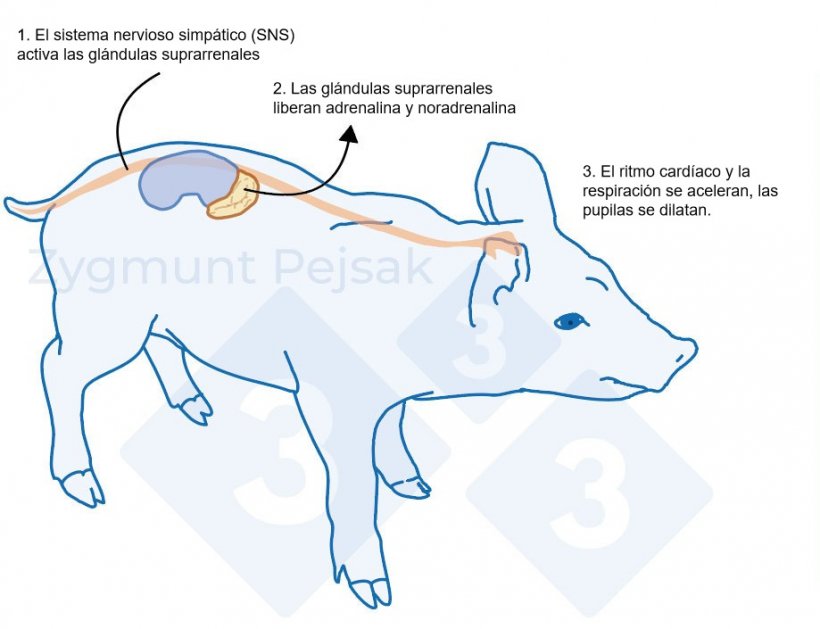
Figura 1. Después de un factor estresante, el sistema simpático estimula las glándulas suprarrenales para que liberen adrenalina y noradrenalina. La activación del sistema simpático en cerdos puede medirse mediante la cromogranina A (CgA).
El otro eje, el HPA, se activa minutos u horas después de que se produzca el estrés (Lightman, 2008), como se ilustra en la figura 2. El cortisol producido por esta respuesta de estrés se ha utilizado ampliamente como marcador de estrés en porcino, también como prueba no invasiva a partir de la saliva (Hillman et al., 2008; Ruis et al., 1997; Valros et al., 2013).
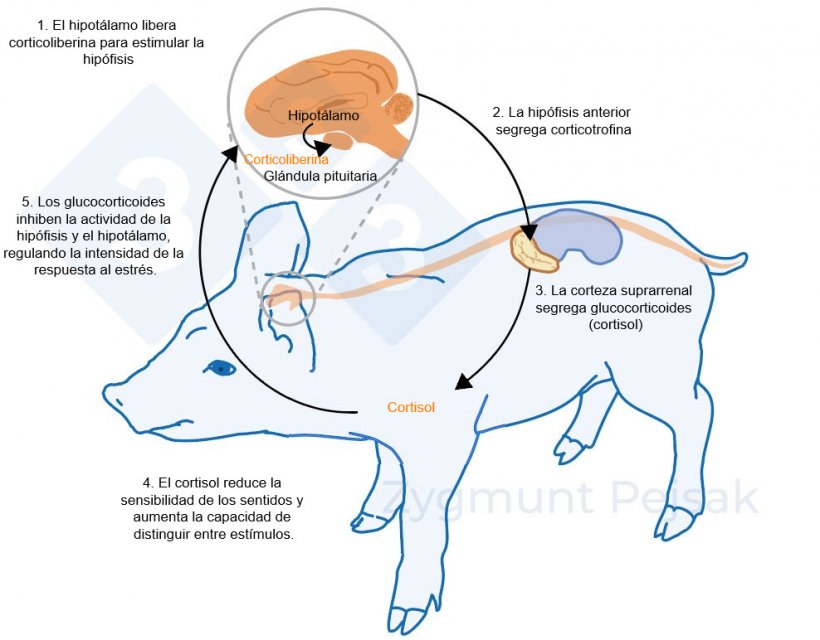
Figura 2. Minutos u horas después de que se produzca el estrés, se activa el eje hipotalámico-hipofisario-suprarrenal (HPA). La hipófisis segrega corticotrofina que, al llegar a la corteza suprarrenal, provoca la secreción de glucocorticoides, entre ellos el cortisol. Los glucocorticoides inhiben la actividad de la hipófisis y el hipotálamo, gracias a lo cual regulan la intensidad de la respuesta al estrés. El cortisol se ha utilizado ampliamente como marcador de estrés en cerdos, también como prueba no invasiva a partir de la saliva.
Los glicocorticoides tienen un efecto negativo sobre el sistema inmunitario. Pueden influir en la respuesta inmunitaria innata, reduciendo el número de monocitos en circulación y, por tanto, también las citocinas proinflamatorias. Los glucocorticoides inhiben el tráfico leucocitario y el acceso de los leucocitos al lugar de la inflamación (Strehl et al., 2019). Un estrés fuerte y prolongado inhibe la respuesta humoral y celular del sistema inmunitario, lo que da lugar a una "hiperadaptación", que a menudo conduce a la manifestación de una enfermedad (Wrona - Polanska, 2008). Los detalles de los efectos se describen en la figura 3. Mientras tanto, un estrés psicológico breve, como el aislamiento social de los lechones, induce un estado de resistencia al cortisol en las células inmunitarias de la sangre, que puede ser una adaptación destinada a mantener las respuestas inmunitarias celulares a corto plazo (Escribano et al., 2013).
Tabla 1. Existen dos reacciones frente el estrés: una reacción activa, que consiste en atacar o huir, y una reacción pasiva, que consiste en la inmovilidad y la depresión durante el estrés de mayor duración.
| Estrés breve: reacción activa | Estrés prolongado: reacción pasiva |
|---|---|
| Un estrés psicológico breve induce un estado de resistencia al cortisol en las células inmunitarias de la sangre. | Los glucocorticoides tienen un efecto negativo sobre el sistema inmunitario: |
|
↑ Linfocitos CD8+ ↓ Ratio CD4+/CD8+ |
↓ Monocitos en circulación ↓ Citocinas proinflamatorias IL-2, IL-6, TNF-α y IL-12 ↓ Diferenciación de linfocitos Th1 ↓ Linfocitos T ↓ IL-2 (necesaria para los linfocitos T) ↓ Tráfico leucocitario ↓ Respuesta humoral ↓ Respuesta celular ↓ Reactividad de los linfocitos ↓ Producción de linfocitos (a veces incluso activan el proceso de su apoptosis) |
Hay algunos biomarcadores inmunitarios que cambian inmediatamente después del estrés y, por lo tanto, podrían utilizarse fácilmente como biomarcadores de estrés agudo (Puppe et al., 1997). Entre ellos se incluyen:
- Aumento de la relación neutrófilos/linfocitos
- Amiloide sérico salival A
- Inmunoglobulina (Ig A)
- IL-18
El estrés agudo está frecuentemente asociado a una respuesta proinflamatoria, que puede ser útil para poner en marcha el sistema inmunitario para luchar y recuperarse (Dhabhar et al., 1995). En general, el estrés crónico o repetido reduce la respuesta inmunitaria, mientras que una única exposición al estrés mejora la inmunidad (Dhabhar, 2009). Los estudios sobre la inmunidad innata en cerdos también corroboran esta afirmación. Sin embargo, el efecto final de un estresor también depende de los factores de estrés. La tabla 2 presenta una lista de factores de estrés agudo y crónico y sus respuestas en los cerdos. La tabla también muestra que el efecto del estrés sobre la respuesta inmunitaria también puede influir en los individuos in utero.
Tabla 2. La respuesta al estrés depende del factor de estrés.
| Factor de estrés | Respuesta | Estudio | |
|---|---|---|---|
 |
Transporte corto (20 minutos) |
↑ algunas proteínas de fase aguda (APP), haptoglobina y proteína C reactiva (CRP) ↑ ratio neutrófilos/linfocitos |
Dhabhar, 2009; Puppe et al., 1997 |
 |
Transporte largo (más de 6 h) |
↑ citoquinas proinflamatorias (IL-2, IL-6, IL-12, IL-1β e IFN-γ) ↓ citoquina antiinflamatoria IL-4 |
De et al., 2021 |
 |
Estrés agudo por inmovilización |
Estimulación del SNS ↑ IL-18 en saliva |
Piñeiro et al., 2007 |
| Aislamiento de lechones | ↑ IL-6 ARNm en el hipotálamo | Tuchscherer et al., 2004 | |
| Aislamiento social repetido de lechones | ↑ citoquinas (IL-1β) |
Kanitz et al., 2004; Tuchscherer et al., 2004 |
|
 |
Estrés social | Supresión de la respuesta inmunitaria de una vacuna vírica y, en consecuencia, disminuye la protección contra una infección, de forma más pronunciada en los individuos dominantes que en los subordinados sometidos a estrés social. | Groot et al., 2001 |
| Estrés social crónico |
Influencia inmunosupresora Disminución significativa de las citocinas proinflamatorias (TNF-α, IL-1β e IL-8), probablemente debida a un fuerte aumento de la expresión de IL-10 en el íleon y el colon. |
Bennett et al., 2015 | |
 |
Estrés prolongado asociado a la interrupción de la ingesta de alimento | ↑ APP, especialmente en machos | Muneta et al., 2011 |
 |
Estrés térmico fetal (in utero) | ↑ respuesta de citoquinas (TNF-α, IL-1β e IL-6) al lipopolisacárido (LPS) en fetos in utero en comparación con fetos no expuestos a estrés térmico, probablemente debido a una respuesta metabólica y de cortisol alterada. | Johnson et al. 2020 |
| Estrés térmico crónico | Ningún efecto sobre la proliferación de linfocitos |
Bonnette et al., 1990; Morrow-Tesch et al., 1994 |
|
| 14 días de exposición al calor y al estrés por hacinamiento |
↑ proliferación de linfocitos T y citotoxicidad de células NK Sin efecto en la concentración total de IgG |
Sutherland et al., 2006 | |
 |
4 días de estrés por frío |
↓ Actividad NK ↓ Proliferación de células T ↓ Concentración total de IgG en plasma |
Salak-Johnson et al., 2018 |
 |
Estrés materno |
↓ Nivel sérico de IgG en lechones lactantes e inmunosupresión de la proliferación de linfocitos B y T Sin cambios en la citotoxicidad de las células NK ↓ peso del timo |
Tuchscherer et al., 2002 |
Parece que el efecto final del estrés sobre el sistema inmunitario depende no sólo de la duración del estrés y de los factores estresantes, sino también del individuo expuesto a este estrés. El estrés social parece suprimir la respuesta inmunitaria a una vacuna vírica y, en consecuencia, deteriora la protección contra una infección, más en los individuos dominantes que en los subordinados sometidos a estrés social (Groot et al., 2001). En general, los cerdos socialmente dominantes y sumisos mostraron alteraciones en la función inmunitaria (elevado número de neutrófilos y menor producción de anticuerpos) en comparación con los cerdos socialmente más neutros. El calor y el estrés social interactúan en su efecto sobre el sistema inmunitario del cerdo y causan inmunosupresión en los cerdos socialmente más neutros, aunque también hay costos inmunológicos para los cerdos dominantes (Mc Kim et al., 2018).
El estrés también está relacionado con estereotipias e incluso con trastornos destructivos, como morderse la cola, que pueden contrarrestarse mediante el enriquecimiento ambiental (D'Eath et al., 2004). Lo interesante es que el enriquecimiento ambiental también puede afectar a ciertos componentes del sistema inmunitario (Luo et al., 2017; Manciocco et al., 2011; Reimert et al. 2014; Scollo et al., 2013; Scott et al., 2006). Algunos datos indican ratios N:L y niveles de haptoglobina más bajos en cerdos alojados en jaulas enriquecidas, lo que sugiere que están menos estresados y su sistema inmunitario está menos activado (Beattie et al., 2000). Estos resultados confirman la relación del estrés con el sistema inmunitario, así como el efecto beneficioso del enriquecimiento sobre el comportamiento y el bienestar de los cerdos. Cabe destacar que una activación a corto plazo del sistema inmunitario y de la respuesta proinflamatoria puede ser beneficiosa, aunque tenga un efecto negativo a largo plazo.




