¿Quién no ha conseguido atascar todos los bebederos de una transición después de establecer una medicación en el agua de bebida? ¿Cuántas veces no hemos culpado al producto empleado de dicho problema?

Atascar los bebederos no es lo peor que puede ocurrirnos, de hecho, si esto sucede sabremos que los cerdos no han tomado ni agua, ni medicación. Pero en ocasiones las medicaciones fallan sin saber por qué. Es en estas situaciones cuando aparecen las dudas: dudamos del producto, de la dosis, del empleado que realizó la medicación o incluso del diagnóstico, a la vista de los malos resultados obtenidos.
Para que una molécula sea soluble en agua debe ser capaz de ionizarse, si no posee radicales ionizables precipitará y se sedimentará en el fondo, en caso de medicar en un depósito. Esto es lo que sucedería si pretendiéramos utilizar una medicación en presentación de “premezcla” en el agua de bebida.


Una molécula capaz de ionizarse al contacto con el agua sería por ejemplo una sal y esta es una de las presentaciones más comunes de las medicaciones solubles. Una sal se disociará en dos tipos de radicales: ácidos (positivos) y básicos (negativos). No todas las moléculas empleadas se disociarán dando la misma cantidad de radicales ácidos y básicos. Esta característica de disociarse en más o menos radicales ácidos se expresa mediante la constante pKa. Cuánto más pequeña sea esta constante, el carácter de la molécula será más ácido. Así, con un pKa de 2,7 (el de la fenoximetilpenicilina) la molécula será considerada como ácido, mientras que con un pKa de 7,6 (el de la lincomicina) será considerada como base. Cuando el pH del medio en que esté disuelta coincida con su pKa, la molécula se encontrará ionizada en un 50%. Para tener una buena solución la ionización debería ser total. Así,
- Una molécula que posea un carácter básico débil se ionizaría mejor en un pH ácido (aguas de suelos graníticos).
- Una molécula con carácter ácido débil se ionizará mejor en medio básico (aguas de suelos calcáreos).
Entre las moléculas que podríamos clasificar como ácidos débiles encontramos: Ampicilina, fenoximetilpenicilina, amoxicilina, quinolonas, etc.
Entre las moléculas que podríamos clasificar como bases débiles encontramos:
Macrólidos, lincosamidas, tiamulina, tetraciclinas, etc.
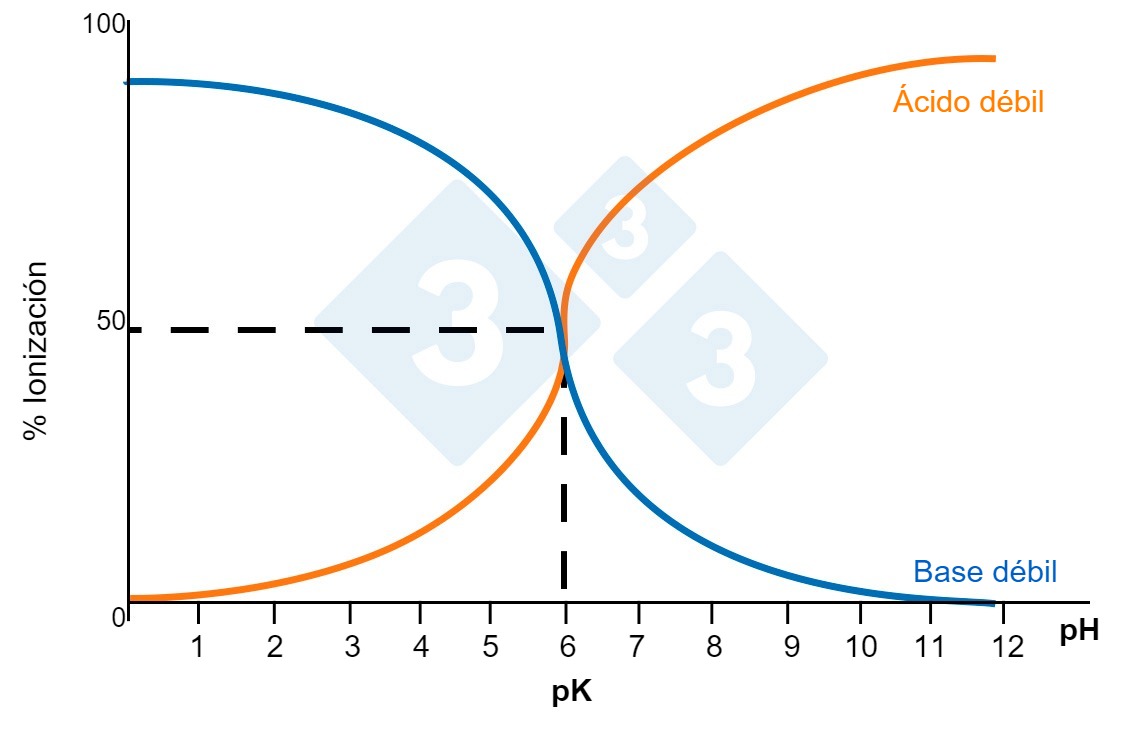
En la práctica, acidificar o neutralizar ligeramente el agua de bebida puede ser interesante para conseguir mejorar la solubilidad de los productos empleados.
Tip: Para evitar problemas con moléculas del tipo bases débiles como por ejemplo las tetraciclinas, la acidificación del agua de bebida sería una medida recomendable.
En el caso de sustancias clasificadas como ácidos débiles como la amoxicilina, la ampicilina o la fenoximeltilpenicilina es recomendable evitar su uso en aguas acidificadas (muy frecuentes en fases tempranas como es la fase de post-destete).
De hecho, aguas fuertemente ácidas (pH < 5) podrían incluso limitar la capacidad de estas sustancias afectando los resultados que se podrían obtener con estas medicaciones.



