Inmunidad maternal
En los cerdos, el desarrollo del sistema inmune empieza a principios de la gestación: en fetos de 30-40 días aparecen las células B y T en el bazo y el timo respectivamente y aumentan progresivamente hasta el final de la gestación. El feto es capaz de desencadenar una respuesta inmune cuando se le administran antígenos por vía parenteral o entérica.

La placenta epiteliocorial no permite el paso ni de anticuerpos ni de células inmunes de la cerda hacia los fetos, por lo que la supervivencia de los lechones neonatos depende de manera crítica de la ingestión de anticuerpos maternales, o MDA (del inglés, Maternal Derived Antibodies), contenidos en el calostro y la leche.
El calostro y la leche tienen diversas funciones:
- Conferir protección sistémica y local gracias a los MDA de la sangre de la cerda, que se traslocan del epitelio mamario a las secreciones mamarias
- Transferir células inmunes maternas a los neonatos
- Influenciar el desarrollo de la inmunidad sistémica y de las mucosas del neonato
- Presencia de hormonas, proteínas antimicrobianas (AMP), factores de crecimiento
El calostro confiere componentes nutricionales al neonato, anticuerpos maternales, células inmunes (células fagocíticas inflamatorias, linfocitos), hormonas (prolactina y cortisol que intervienen en la regulación del crecimiento de las células epiteliales del intestino) factores de crecimiento (p.e. TGFb, implicado tanto en la inducción de la inmunotolerancia como en la conmutación de anticuerpos para la producción local de IgA), proteínas antimicrobianas (lactoferrina, defensinas, suero amiloide A).
Una vez ingerido el calostro, las inmunoglobulinas maternales (IgG, IgM e IgA) pasan a través de los enterocitos y llegan al torrente sanguíneo gracias a la permeabilidad intestinal completa. Durante 24 horas, las IgGs (principal isotipo del calostro) pasan de las secreciones mamarias a la sangre del neonato, donde alcanzan una concentración sérica parecida a la de la cerda, mientras que las IgA, una vez llegan a la sangre, circulan hasta alcanzar el epitelio respiratorio por exudación y también llegan al epitelio intestinal.
La protección pasiva sistémica y local conferida por el calostro se debe, principalmente, a los MDA y la mayoría de las IgG e IgMs del calostro derivan del suero de la cerda.
En el calostro también hay linfocitos T y B que pueden pasar a la sangre del neonato tras la ingesta de calostro. Se caracterizan por ser células de memoria capaces de proliferar y activarse en respuesta a antígenos virales y bacterianos y para producir citoquinas. Los linfocitos B del calostro atraviesan el epitelio intestinal, se dirigen a los linfonodos mesentéricos y luego, a través de la sangre, hacia otros tejidos, donde tienen un efecto inmunoestimulador. Se han demostrado respuestas proliferativas de las células calostrales a antígenos "recordados" pero todavía no está clara la transferencia de inmunidad específica medidada por células del calostro.
Hasta el destete la protección contra patógenos locales se basa, principalmente, en la inmunidad conferida por la leche (inmunidad lactogénica), que depende de la activación inmune en los sitios de inducción de la cerda y en la transferencia de células B activadas hacia la glándula mamaria con producción local de IgA secretoras. La activación inmune en las cerdas se produce en el tejido linfoide asociado con el intestino (GALT, Gut-associated lymphoid tissue), con recirculación linfocitaria entre el intestino y la glándula mamaria, y en el tejido linfoide asociado a los bronquios (BALT, bronchus-associated lymphoid tissue), con recirculación de células B entre el sistema respiratorio y la glándula mamaria (figura 1).
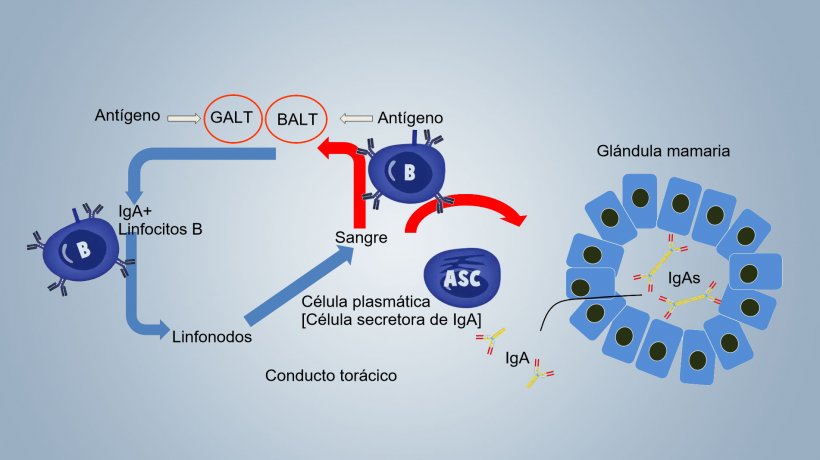
Figura 1. Esquema de la inmunidad lactogénica.
Las IgAs de la leche derivan de las IgAs diméricas, secretadas en los sitios de inducción, que pasan a las secreciones mamarias por translocación a través del epitelio mamario y de los linfocitos B IgA + sensibilizados en los sitios de inducción, que pasan de la sangre a la glándula mamaria donde se transforman en células secretoras de IgA (ASCs IgA +), que secretan localmente Ig que pasan a la leche (figura1).
Inmunidad neonatal
La inmunidad del lechón hasta el destete depende de:
- Inmunidad maternal pasiva
- Inmunidad congénita adquirida que se desarrolla progresivamente en el periodo pre- y post-destete
En el momento del nacimiento, las células "naïve" T CD4 + se mantienen a niveles más elevados que las T CD8 +, mientras que los linfocitos T helper CD4 + CD8 + (memoria) y los linfocitos citotóxicos CD8 + sólo aumentan en el periodo post-destete. Por el contrario, hay niveles elevados de linfocitos T g/d durante el periodo pre-destete. Los linfocitos B aumentan su número en las primeras 4 semanas de vida pero la diversidad de su repertorio de anticuerpos ya está completa a las 4 semanas de edad.

La figura 2 esquematiza los factores que influencian el desarrollo de la inmunidad neonatal.
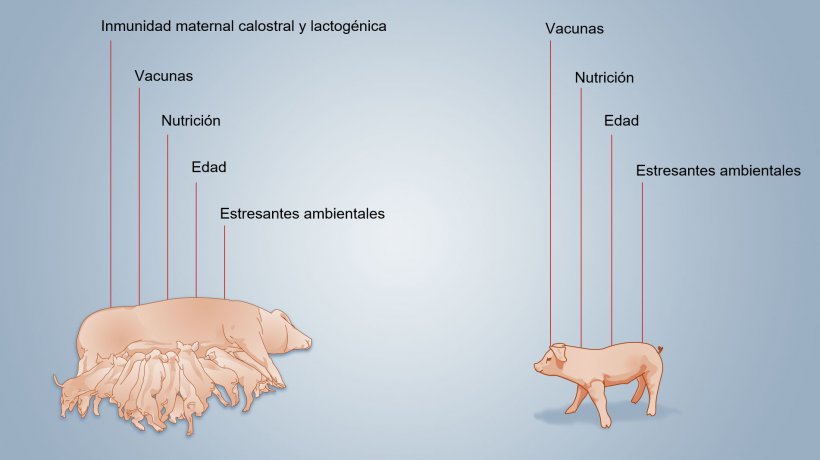
Figura 2. Factores que influyen sobre el desarrollo de la inmunidad neonatal.
El desarrollo de la inmunidad adquirida es lento, debido en parte, a que la estimulación antigénica es limitada hasta el destete debido a la interferencia de los MDA que, al bloquear a los antígenos, puede influir en el desarrollo de la inmunidad específica para antígenos. También hay que tener en cuenta los estresantes ambientales, como vacunas o microbioma, que pueden influir positiva o negativamente en el desarrollo cuantitativo y cualitativo de la respuesta inmune del lechón.
La exposición, a una edad temprana, a una flora microbiana adecuada lleva a la expansión y desarrollo de un sistema inmunitario eficiente.
El destete temprano del lechón es crítico para el desarrollo de la inmunidad adquirida debido a que representa una fase en la que los estresores físicos y psíquicos juegan un papel importante alterando la producción de hormonas inmunomodularosas (GH, cortisol, prolactina) y afectan de varios modos a la efectividad de la respuesta inmune a nivel sistémico y de mucosas.



