|
Figura 1. Microfotografía electrónica de dos cuerpos de inclusión en el citoplasma de un macrófago, que incluyen un muy elevado número de partículas de circovirus porcino tipo 2.
Aumento original: 150.000x |
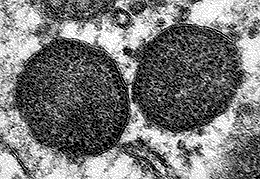 Carolina Rodríguez-Cariño, CReSA |
|
Figura 2. Árbol filogenético truncado que indica la existencia de dos grupos (genotipos) de cepas de PCV2 en base a las secuencias del ORF2. Una diferencia de identidad nucleotídica del 3,5% (punto de corte de la flecha vertical) entre cepas permite diferenciar a las cepas de los distintos genotipos. La mayor variabilidad entre las cepas de genotipo 2 sugiere que se trata de un genotipo temporalmente anterior al 1
|
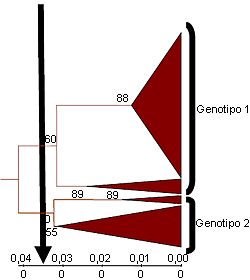 Modificado de Grau-Roma et al., 2007 |
¿Qué se puede esperar de una enfermedad multifactorial desde un punto de vista etiológico? Sin duda, al menos de entrada, ¡confusión! Para algunas enfermedades parece que estemos cambiando la terminología “agente causal de…” por “agente esencial de…”. De hecho, la primera es indiscutible en el marco de las llamadas enfermedades “unifactoriales”, pero la realidad es que éstas son realmente muy pocas entre la patología porcina actual y la mayoría de ellas se encuentran marcadamente moduladas o potenciadas por una serie de factores infecciosos y no infecciosos distintos al presunto agente causal. Esta es la situación de la circovirosis porcina.
El circovirus porcino tipo 2 en un agente vírico de 17 nm de diámetro, uno de los más pequeños entre los virus animales (Fig. 1). Presenta una organización estructural relativamente simple: virus sin envuelta, con una cápside formada mayoritariamente por una sola proteína (proteína Cap o producto del fragmento de lectura abierto 2 [ORF2]), y una cadena simple de ADN de aproximadamente 1767-68 nucleótidos. Este genoma también codifica por proteínas involucradas en la replicación vírica (Rep y Rep’, productos del ORF1). Existiría un ORF3 que se especula podría codificar una proteína con capacidad apoptótica; no obstante, la función de esta proteína no está clara actualmente. Es un virus altamente resistente y, por definición, de difícil eliminación con el uso de desinfectantes. Entre ellos, se consideran de utilidad para disminuir la carga vírica in vitro a la clorhexidina, formaldehídos, iodina y lejía.

Desde el punto de vista filogenético se consideran dos grandes grupos de PCV2. Estas agrupaciones se han definido muy recientemente como dos genotipos distintos (1 y 2), considerándose el genotipo 2 como más antiguo desde el punto de vista evolutivo (Fig. 2). Vista esta clasificación, es lógico preguntarse si todos los genotipos de PCV2 presentan la misma virulencia o no. La respuesta a esta cuestión no es clara. Si consideramos como “éxito” de una infección experimental con PCV2 el hecho de que al menos un animal enferme de circovirosis porcina, uno puede concluir que ambos genotipos son patógenos. No obstante, esta patogenicidad está mediada por factores desencadenantes para ambos genotipos. Si medimos este “éxito” como la proporción de experimentos que consiguen al menos un cerdo con enfermedad, entonces nos damos cuenta que el porcentaje es mayor con el genotipo 1. ¿Es, pues, el genotipo 1 más virulento que el 2?. La respuesta tampoco es tan fácil, pero en la actualidad existen indicios de que así podría ser:
- Los casos de aparición epizoótica en Norte-América se han asociado a un incremento muy marcado de prevalencia de cepas de PCV2 de genotipo 1
- Un estudio reciente realizado en Europa asocia sistemáticamente el genotipo 1 a la existencia de enfermedad, mientras que no siempre es el caso con el genotipo 2
Si estos datos podrían explicar la aparición de brotes epizoóticos de circovirosis porcina a finales de los 90 en Europa y Sureste Asiático y en 2004-05 en Norte y Sur-América es algo que no está demostrado. Una posible hipótesis consistiría en que el genotipo 2 de PCV2, potencialmente menos virulento, ha sido el genotipo más frecuente durante mucho tiempo, con casos esporádicos de enfermedad (al menos desde 1986); la irrupción de un genotipo más patogénico, presuntamente el genotipo 1, podría haber sido el responsable de los brotes epizoóticos de la enfermedad mencionados anteriormente. Esperemos que los próximos años se pueda dirimir la validez o no de esta hipótesis. Cabe destacar, no obstante, que incluso dentro de un mismo genotipo, podrían existir diferencias de patogenicidad, como se ha demostrado recientemente en una infección experimental. Por otro lado, y a pesar de la existencia de diferencias antigénicas entre distintos aislados de PCV2, la eficacia de las vacunas con independencia del genotipo de desafío sugiere que aunque existan dos genotipos, podría existir solamente un serotipo de PCV2.
No obstante, ya desde hace casi 10 años, existe otra hipótesis para explicar la irrupción de la circovirosis porcina a nivel mundial: el “agente X”. Se trataría de un agente que actuaría facilitando una sobre-replicación de PCV2 y, por tanto, jugaría un papel como factor desencadenante de la enfermedad en el 100% de los casos. Esta hipótesis se ha sustentado en la controversia sobre PCV2 de ¿cómo un virus ubicuo podría ser causa de enfermedad? Lógicamente, esta hipótesis es anterior a la posible irrupción de genotipos de PCV2 con distinta virulencia. Lo que si es cierto es que después de estos 10 años, nadie ha podido aislar o detectar este posible “agente X”, y los datos de infecciones experimentales con “éxito” explicarían de forma muy difícil la existencia de un “agente X”. Si este “agente X” fuera el responsable del desencadenamiento de algunos casos de enfermedad, entonces se comportaría de forma similar a como lo hacen el parvovirus porcino, el virus del síndrome respiratorio y reproductivo porcino y Mycoplasma hyopneumoniae (desencadenadores de la enfermedad en cerdos co-infectados con PCV2). En todos los casos, ¡¡nunca un agente cuya existencia se desconoce había generado tantos comentarios!! Cabe decir, no obstante, que, a pesar de la gran eficacia demostrada por las vacunas frente a PCV2, ello tampoco descarta la existencia del famoso “agente X”.




